 | |
МЕНЮ
- Главная
- Языкознание филология
- Финансовые науки
- Управленческие науки
- Товароведение
- Технология
- Теплотехника
- Теория организации
- Теория государства и права
- Таможенная система
- Схемотехника
- Строительство
- Страхование
- Статистика
- Религия и мифология
- Психология и педагогика
- Промышленность производство
- Медицинские науки
- Медицина
- Краеведение и этнография
- Компьютерные науки
- История
- Искусство и культура
- Информатика
- Инвестиции
- Издательское дело и полиграфия
- Зоология
- Журналистика
- Естествознание
- Деньги и кредит
- Делопроизводство
- Гражданское право и процесс
- Государство и право
- Геополитика
- Геология
- Геодезия
- География
- Военная кафедра
- Ветеринария
- Валютные отношения
- Бухгалтерский учет и аудит
- Ботаника и сельское хоз-во
- Биржевое дело
- Биология и химия
- Биология
- Безопасность жизнедеятельности
- Банковское дело
- Астрономия
- Астрология
- Архитектура
- Арбитражный процесс
- Административное право
- Авиация и космонавтика
- Карта сайта
Дипломная работа: Методы диагностики и профилактики микробной контаминации при трансплантации эмбрионов
Анализ литературных данных показал, что несмотря на достигнутые успехи в эмбриотрансплантации, проблемными остаются вопросы по приживляемости эмбрионов. Известно много причин, влияющих на приживляемость эмбрионов, одной из которых является микробный фактор. Хотя многие известные ученые не учитывают влияние микрофлоры на жизнеспособность и приживляемость эмбрионов считая, что эмбрионы с интактной зоной пеллюцида надежно защищены от микробов и вирусов. Однако в литературе есть данные о том, что некоторые вирусы и прилипают к прозрачной оболочке и заносятся вместе с эмбрионом в матку реципиента, оказывая негативное влияние на него. Недостаточное количество противоречивых данных о влиянии микроорганизмов на приживляемость эмбрионов стало основанием для проведения исследований по данной проблеме.
С целью предупреждения заноса инфекции при трансплантации отечественными и зарубежными учеными разработаны различные технологии, приемлемые в хорошо оборудованных центрах трансплантации эмбрионов. В производственных условиях необходимы дополнительные меры профилактики микробной загрязненности. Известно, что лучшими антимикробными средствами являются антибиотики. Тем не менее, в доступной для нас литературе мало данных о влиянии антибиотиков на эмбрионы. Поэтому перед нами встала задача изучить влияние различных антибиотиков и их доз для профилактики микробной контаминации на всех этапах эмбриотрансплантации.
2. Собственные исследования
2.1 Цель и задачи
Целью нашей работы была разработка методов профилактики и санитарного контроля технологических процессов при трансплантации эмбрионов у крупного рогатого скота.
Для достижения этой цели нами поставлены на разрешение следующие задачи:
1. Изучить бактериальную контаминацию половых путей телок-реципиентов в фолликулярную и лютеальную фазы полового цикла.
2. Изучить влияние антибактериальных препаратов на микрофлору половых путей после их санации непосредственно перед извлечением и пересадкой эмбрионов.
3. Провести сравнительную оценку антибактериальных препаратов для санации половых путей.
4. Испытать антибиотики для санации промывных буферных сред и отмывки эмбрионов.
5. Изучить влияние испытанных нами антибактериальных препаратов на жизнеспособность и приживляемость эмбрионов.
2.2 Материалы и методика исследований
Все исследования по данной работе проводились в лаборатории трансплантации эмбрионов сельскохозяйственных животных Харьковского биотехнологического центра Украинской академии аграрных наук и на пункте трансплантации эмбрионов опытного хозяйства «Кутузовка». Работа выполнялась в период с июля 2000 года по август 2001 года.
Пункт трансплантации эмбрионов крупного рогатого скота, построенный по типовому проекту, имеет манеж для санитарной обработки животных перед операцией, операционную, поисковую и стерильный бокс для первичной обработки эмбрионов, помещение для замораживания и хранения эмбрионов, моечную и др. В манеже и операционной расположены специальные фиксационные станки. Операционная, поисковая и стерильный бокс оборудованы бактерицидными лампами. Пункт оснащен необходимым лабораторным, технологическим оборудованием и лабораторной посудой.
Предметом исследования были коровы и телки черно-пестрой породы и полученные от них эмбрионы.
В опытном хозяйстве «Кутузовка» беспривязная система содержания на глубокой несменяемой подстилке.
Кормление животных проводили по общепринятым нормам. Рационы были сбалансированы по общей питательности, белку, фосфору, кальцию и витаминным добавкам.
Животные регулярно подвергались ветеринарно-профилактическим и санитарным обработкам, клинико-гинекологическим обследованиям, постоянно находились под ветеринарно-зоотехническим наблюдением.
Исследования проводили на коровах-донорах и телках-реципиентах с нормальным состоянием половых органов и цикличностью воспроизводительной функции. Опытная группа состояла из коров в возрасте 3–8 лет, с живой массой 500–600 кг и телок в возрасте 16–18 месяца, с живой массой 350–380 кг. В контрольную группу отбирали коров и телок методом пар-аналогов. В экспериментах использовано 25 коров-доноров и 60 телок – реципиентов. Для вызывания суперовуляции применяли препараты ФСГ.
Животные обрабатывались по 4-х дневной схеме ФСГ‑п производства фирм «Schering Corp» или» Burns Biotec» США и ФСГ-супер (Россия) в общей дозе 50 мг (Табл. 1).
Таблица 1. Схема гормональной обработки коров-доноров препаратом ФСГ‑п (50 мг) производства США
| День эстрального цикла | Название препарата | Доза (мг) | Общая доза | |
| утро | вечер | |||
| 10–12 | ФСГ‑п | 7 | 7 | 14 |
| 11–13 | ФСГ‑п | 6,5 | 6,5 | 13 |
| 12–14 | ФСГ‑п | 6 | 6 | 12 |
| Простогландин | 250 | 250 | 500 мкг | |
| 13–15 | ФСГ‑п | 5,5 | 5,5 | 11 |
| 14–16 | Охота и осеменение | |||
| 21–23 | Нехирургическое извлечение эмбрионов | |||
Синхронизация полового цикла доноров и реципиентов осуществлялась инъекцией экстрофана.
Осеменение коров-доноров проводилось двукратно двойной дозой замороженно-оттаянной спермы с содержанием не менее 25 млн. активных спермиев (рис. 1). Из спермодозы готовили мазки для определения патологических форм спермиев. Мазки высушивали, фиксировали и окрашивали гематоксилином Караччи. Сперму, содержащую 18% и более патологических спермиев, выбраковывали, так как высокий процент патологических спермиев снижает оплодотворяющую способность спермы.
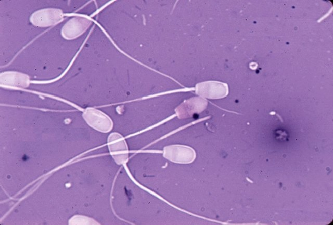
Рис. 1. Нормальные спермии быка
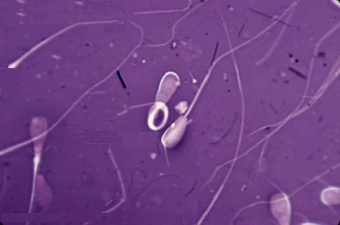
Рис. 2. Патологические формы спермиев
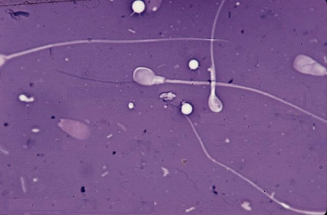
Рис. 3. Патологические формы спермиев
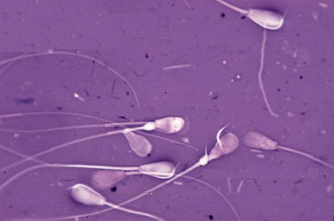
Рис. 4. Патологические формы спермиев
Для бактериологических исследований использовали мясо-пептонный агар (МПА) и мясо-пептонный бульон (МПБ), среду Китт-Тароцци, Сабуро и Булира, агар Эндо.
МПА и МПБ использовали для культивирования различных микроорганизмов неопределенного состава.
Для культивирования анаэробных микроорганизмов использовали среду Китт-Тароцци (МППБ).
Среду Булира и агар Эндо применяли для культивирования кишечной палочки.
Для выращивания грибов использовали среду Сабуро.
Все среды перед бактериологическим исследованием разливали в пробирки по 5 мл. Пробирки закрывали ватно-марлевыми пробками и стерилизовали автоклавированием при температуре 120°С в течение 15–30 минут. МПА после стерилизации скашивали, установив пробирки в наклонном положении до застывания среды.
Среду, предназначенную для культивирования бактерий на чашках разливали по 20–25 мл и оставляли на несколько минут до застывания агара. Когда требовалось вырастить микроорганизмы на агарезированной среде в виде изолированных колоний, чашки после засева помещали в термостат дном вверх.
Отбор проб для бактериологических исследований проводили на всех этапах подготовки эмбрионов к трансплантации.
2.2.1 Подготовка лаборатории, посуды и инструментов для манипулирования с эмбрионами
В помещениях лаборатории, где подготавливали инструменты, оборудование, посуду, среды для получения, пересадки и криоконсервации эмбрионов, ежедневно проводили влажную уборку.
Все оборудование бокса, его стены, пол не реже одного раза в неделю мыли моющими средствами и протирали дезинфицирующими растворами. Для дезинфекции использовали 2%-й раствор хлорамина «Б». Перед работой бокс и другие помещения лаборатории облучали в течение 40–60 минут ультрафиолетовыми лучами из расчета 2–3 вт/м.
В боксе в день работы с эмбрионами проводили дополнительную обработку столов и оборудования 96° этанолом.
Все сотрудники лаборатории работали в стерильных халатах и сменной обуви. Спецодежду (халаты, косынки, шапочки, марлевые повязки) стирали не реже одного раза в неделю с обязательным кипячением и проглаживанием утюгом. Обувь регулярно по окончании работы мыли и обеззараживали 2%-м раствором хлорамина.
Употребляемые для работы с эмбрионами инструменты, посуду стерилизовали различными способами в зависимости от материала, из которого они изготовлены.
Стеклянную посуду (флаконы, колбы, пипетки, цилиндры и пр.), а также инструменты для пересадки эмбрионов закрывали пергаментной бумагой и стерилизовали автоклавированием при 1,5 атм. в течение 30 мин. Затем сушили при температуре 80°С в течение 60 минут.
Шприцы, иглы, пинцеты, ножницы, влагалищные зеркала и системы для вымывания эмбрионов стерилизовали кипячением в течение 30 минут.
Перед стерилизацией новую стеклянную посуду мыли водопроводной водой с мылом или порошком, с помощью щеток и ершей, ополаскивали и погружали в раствор соляной кислоты (1 ст. ложка соляной кислоты на 3 литра дистиллированной воды) и выдерживали в нем 24 часа. После чего посуду отмывали в проточной воде, а затем многократно в би- и тридистиллированной воде и высушивали.
Бывшую в употреблении стеклянную посуду мыли в горячем 2–3% растворе двууглекислой соды, затем тщательноополаскивали водопроводной водой, после чего би- и тридистиллированной водой и высушивали.
Бывшие в употреблении металлические предметы также мыли в вышеуказанном растворе соды, ополаскивали водопроводной, би- и тридистиллированной водой и высушивали.
Одноразовые полимерные инструменты (ампулы, чехлы, пипетки и др.) стерилизовали в боксе путем их облучения бактерицидными лампами БУФ‑30 или ПРК‑2 в течение 20 мин. с обеих сторон на расстоянии 20 см от источника облучения.
Резиновые инструменты (катетер для вымывания) обрабатывали 70°С спиртом-ректификатом. Наружную поверхность стерилизовали, облучая лампами БУФ‑30 в течение 20 мин. на расстоянии 20 см от источника ультрафиолетовых лучей, перед работой ополаскивали 2–3 раза средой Дюльбекко.
4.2.2 Подготовка доноров и реципиентов
Подготовку донора начинали в манеже с чистки и мытья кожного покрова и конечностей. Затем животное переводили в операционную, фиксировали в станке, прямую кишку освобождали от содержимого. Для снятия напряжения прямой кишки проводили эпидуральную анестезию 2%-ым раствором новокаина в дозе 5 мл. По инструкции наружные половые органы и перенеальную область тщательно мыли водой с мылом, осушали салфеткой, дезинфицировали аэрозолем «Септонекс» или 70°-м этанолом. В опытах, корень хвоста, область промежности и наружные половые органы тщательно мыли теплой водой с мылом, осушали ватным тампоном. Кожу наружных половых органов и половые пути (преддверие влагалища, влагалище и влагалищную часть шейки матки) орошали раствором Люголя. Для этой цели хвост отводили в сторону вперед, фиксировали его при помощи веревки за переднюю перегородку станка. Во влагалище вводили подготовленное влагалищное зеркало. Через открытое зеркало орошали слизистые оболочки половых путей раствором Люголя. Через 15 минут после санации половых путей проводили извлечение эмбрионов.
Подготовку реципиентов к пересадке эмбрионов осуществляли также, как и подготовку доноров для нехирургического извлечения зародышей. Для предотвращения заноса микрофлоры в матку реципиента проводили санацию половых путей раствором Люголя за 15 мин. до пересадки эмбрионов.
Приготовление раствора Люголя.
Раствор Люголя готовили по следующей прописи:
кристаллический йод – 1,0 г
йодистый калий – 2,0 г
дистиллированная вода – 300,0 мл.
2,0 г йодистого калия растворяли в 100 мл воды, добавляли 1,0 г кристаллического йода и ставили на 10–12 часов в термостат до полного растворения йода. При этом йод растворяется в йодистом калии. Раствор переливали в большую мерную склянку и доводили общий объем до 300,0 мл. Затем его фильтровали и хранили во флаконах из темного стекла. Раствор использовали не более 30 дней.
4.2.3 Извлечение и подготовка эмбрионов к пересадке
Извлечение эмбрионов проводили на 7-8 день полового цикла нехирургическим методом. Перед операцией донора готовили по методике, описанной в разделе 1.2, затем эпидурально вводили 5–7 мл 2%-го новокаина в зависимости от веса животного. Беспокойным добавочно вводили 0,3–0,5 мл ромпуна. Ректально методом пальпации оценивали состояние полового аппарата, проводили подсчеты желтых тел и фолликулов. Для вымывания эмбрионов использовали катетеры различных конструкций. Промывная жидкость подавалась через закрытую систему самотеком из емкости, расположенной в верхнем гнезде штатива над донором. Промывание маточного рога проводили 8–10 раз, вводя по 60–50 мл промывной среды. На вымывание одного рога расходовали 450–500 мл модифицированной среды Дюльбекко с добавлением 1% инактивированной сыворотки крови крупного рогатого скота.
В научно-производственных опытах по санации промывных буферных сред добавляли комплекс антибиотиков гентамицин-ампициллин в концентрациях 12 мкг/мл и 100 Ед/мл, соответственно. Бактерицидную дозу санирующих препаратов испытывали на штаммах микроорганизмов, как монокультуре, так и в ассоциации, методом серийных разведении. Безвредность санирующих препаратов для эмбрионов определяли методом культивирования эмбрионов крупного рогатого скота в средах содержащих различные дозы испытуемых препаратов.
Эффективность применения санирующих препаратов учитывали по результатам приживляемости эмбрионов.
Смыв отстаивали 15–20 мин. при температуре 37°С в термостате. Надосадочную жидкость аспирировали с помощью сифона. Осадочную среду разливали в стерильные чашки Петри с расчерченным на полоски дном. Поиск зародышей производили под стереоскопическим микроскопом МБС-9.
Обнаруженные эмбрионы переносили стерильным микрошприцем на малую чашку Петри диаметром 40 мм. Жизнеспособность эмбрионов определяли по общепринятой методике оценки морфологического состояния эмбриона (В. Shea et al., 1976), учитывая их компактность, симметричность, плотность. (Инструкция по трансплантации эмбрионов крупного рогатого скота, 1987).
В сравнительных опытах по многократному отмыванию эмбрионов использовали буферные среды, приготовленные за 10–15 мин. до начала поиска эмбрионов. Отмывная среда для эмбрионов состояла из стерильного буфера Дюльбекко с добавлением 15–20% инактивированной фетальной сыворотки, которую в стерильных условиях расфасовывали в полиэтиленовые ампулы по 2 мл. В другой емкости готовили такую же среду с добавлением комплекса антибиотиков гентамицин-ампициллин (12 мкг/мл и 100 Ед/мл). При отмывании использовали микрошприц и микропипетку для захвата эмбрионов с минимальным объемом среды. Устройство применяли с целью захвата, переноса и микробной деконтаминации эмбрионов.
Культивирование эмбрионов проводили при температуре 37,5°С без доступа кислорода в модифицированной среде Дюльбекко, содержащей 20% фетальной сыворотки крупного рогатого скота.
В среду для культивирования подопытных эмбрионов вносили комплекс антибиотиков гентамицин-ампициллин (12 мкг/мл и 100 Ед/мл), в первом контроле использовали пенициллин (100 Ед/мл) и стрептомицин (50 Ед/мл), во втором контроле для культивирования эмбрионов использовали среду без антибиотиков.
Эмбрионы в средах с антибиотиками выдерживали 2 часа. Затем меняли среду и культивировали 72 часа. Морфологическое состояние эмбрионов оценивали через 2, 24, 48 и 72 часа.
4.2.4 Влияние микробного фактора на приживляемость эмбрионов
При проведении опытов по определению влияния микробного фактора на приживляемость эмбрионов использовали чистые культуры микроорганизмов, ранее выделенные из половых путей коров-доноров и телок-реципиентов. Инокуляцию отмытых и подготовленных к пересадке эмбрионов проводили чистыми суточными культурами. Чистые культуры Stapha и Ecoli выделяли методом Коха. Принцип метода заключается в получении чистой культуры из колонии, рост которой считали результатом развития одной клетки.
Для выделения чистой культуры производили высев на поверхность агаровой среды из накопительной культуры (с ее разведения). Разведение делали с таким расчетом, чтобы получить на поверхности агаровой среды изолированные колонии. Для посева на поверхность плотной агаровой среды наносили каплю этой культуры, которую осторожно распределяли по всей поверхности стерильным шпателем с последующим переносом ее на поверхность агара последовательно во вторую, третью и четвертую чашки. В первых двух чашках после инкубации при температуре 37°С для Staph. aureus и 43 «С для E.coli наблюдали «сплошной» рост микроорганизмов, тогда как в последующих чашках отмечали рост изолированных колоний. Одну из колоний отбирали стерильной петлей и производили высевы в пробирки с МПБ и на поверхность скошенного агара. Идентификацию E.coli проводили путем высева на среду Булира и Эндо, a Staph. aureus на МПБ и МПА с добавлением 1% глюкозы.
Чистые культуры Staphaureus и Е. coli в разведении 1:10 контаминировали в среды с эмбрионами.
Для получения определенного количества микроорганизмов в 1 мл среды необходимо было получить суспензию этих культур и приготовить их разведение. Чаще всего для инокуляции используют чистые суточные культуры микроорганизмов в разведении 1:10 – 1:10. Для приготовления таких разведении, стерильный физиологический раствор разливали по 9 мл в стерильные сухие пробирки. Затем 1 мл исходной суспензии, взятой стерильной пипеткой, переносили в первую пробирку с 9 мл стерильного физиологического раствора – получали первое разведение 1:10. Затем этой же пипеткой брали 1 мл полученного разведения и переносили его во вторую пробирку. Получали второе разведение
Таким же образом готовили и последующие разведения.
В эксперименте по определению влияния микробного факторана приживляемость эмбрионов было взято две группы животных-аналогов по 20 голов в каждой. Телкам-реципиентам опытных групп пересаживали эмбрионы, инокулированные чистыми культурами микроорганизмов в вышеуказанных разведениях. 10 животным трансплантировали эмбрионы, инфицированные Staph. aureus, другим 10 – эмбрионы с внесенной культурой E.coli, 20 контрольным телкам пересаживали эмбрионы, отмытые в пяти чашках стерильными буферными средами, без добавления микроорганизмов.
В природе отмечено, что микроорганизмы в ассоциациях могут быть синергистами либо антагонистами. Поэтому нами проведены исследования по определению антагонизма микроорганизмов, выделенных из половых путей самок. В этих опытах применяли метод посева испытуемых микробов на чашках Петри с МПА радиальными штрихами к предварительно выращенным колониям предполагаемого антагониста по методике В.В. Аврех и А.Ф. Зак, описанной в справочнике И.О. Биргера (1973).
В экспериментах по определению бактериальной загрязненности половых путей доноров и реципиентов нами выделено в основном 4 вида бактерий: Bac.subtilis, E.coli, Staph.aureus и Ps.aeruginosa. Перечисленные виды микроорганизмов относятся к группе возбудителей специфических половых инфекций. Известно, что в определенных условиях резистентность организма значительно ослабевает и нормальный количественный и качественный состав микрофлоры изменяется или активизируется деятельность имеющихся микроорганизмов.
Попадание микробов в глубокие отделы полового аппарата самки в природных условиях при естественном спаривании явление не столь уж редкое. Именно вследствие этого возникла у самок активная защитная реакция в эстральном периоде. И у самих зародышей в процессе эволюции выработался защитный механизм, особенно необходимый на ранних стадиях развития, когда еще не существует плацента с ее барьерной функцией. Это подтверждено опытами Б.П. Токина(1956).
ИНТЕРЕСНОЕ
© 2009 Все права защищены. |