 | |
МЕНЮ
- Главная
- Языкознание филология
- Финансовые науки
- Управленческие науки
- Товароведение
- Технология
- Теплотехника
- Теория организации
- Теория государства и права
- Таможенная система
- Схемотехника
- Строительство
- Страхование
- Статистика
- Религия и мифология
- Психология и педагогика
- Промышленность производство
- Медицинские науки
- Медицина
- Краеведение и этнография
- Компьютерные науки
- История
- Искусство и культура
- Информатика
- Инвестиции
- Издательское дело и полиграфия
- Зоология
- Журналистика
- Естествознание
- Деньги и кредит
- Делопроизводство
- Гражданское право и процесс
- Государство и право
- Геополитика
- Геология
- Геодезия
- География
- Военная кафедра
- Ветеринария
- Валютные отношения
- Бухгалтерский учет и аудит
- Ботаника и сельское хоз-во
- Биржевое дело
- Биология и химия
- Биология
- Безопасность жизнедеятельности
- Банковское дело
- Астрономия
- Астрология
- Архитектура
- Арбитражный процесс
- Административное право
- Авиация и космонавтика
- Карта сайта
Дипломная работа: Параметры функционирования митоКАТФ у животных с различной устойчивостью к гипоксии, а также у крыс, адаптированных к кислородному голоданию
IgG элюировали с колонки 0.1М Na-цитратным буфером, pH 3.0. Элюат немедленно титровали 1М Трис-HCl, pH 9.0 до pH 7.0. Затем колонку отмывали 0.1 М Na-фосфатным буфером до pH 7.0.
Концентрацию белка в элюате измеряли на спектрофотометре Shimadzu UV-2401 РС (Япония) при длине волны 280 нм. Чистота IgG проверялась при помощи денатурирующего электрофореза в полиакриламидном геле по методу Лэммли [16]. Очищенные IgG разводили глицерином в соотношении 1:1 и хранили при температуре -20ºС.
3.10 Ингибиторный анализ с использованием антител к белку
с м.м. 55 кДа
Анализ влияния специфических к белку с м.м. 55 кДа антител на параметры функционирования митоКАТФ канала проводили, во-первых, с использованием К+-селективного электрода, определяя скорость ДНФ-индуцированного выхода К+ из МХ и концентрацию ионов К+ в матриксе МХ (см. п.п. 3.2.). Во-вторых, с помощью определения энергозависимого входа К+ в МХ методом спектрофотометрии (см. п.п. 3.1.). При проведении ингибиторного анализа в качестве контроля использовалась преимунная сыворотка, а также сыворотка, содержащая специфические антитела на белок с м.м. 55 кДа, подвергнутая предварительно 5-тиминутному кипячению. Также определялось влияние антител на процесс дыхания МХ.
Глава 4. Выделение комплекса цитоплазматических мембран и микросом печени крыс
Для выделения комплекса цитоплазматических мембран и микросом печени использовали самцов крыс альбиносов линии Вистар, массой ~250г. Крыс умерщвляли декапитацией без наркоза. Печень извлекали и помещали в предварительно взвешенную среду выделения (t 0°С). После определения массы и проведения перфузии 0.9% NaCl, печень продавливали через пресс и гомогенизировали в стеклянном гомогенизаторе с тефлоновым пестиком в 8-кратном объеме среды выделения, отнесенном к исходному весу ткани.
Сначала осаждали МХ дифференциальным центрифугированием, супернатант центрифугировали на 105000 g 1 час, получившийся осадок наносили на градиент (20, 25, 30, 35% сахароза) крутили 105000g 1 час.
Происходило разделение образца на две четкие зоны, 25-30% микросомы, 20% мембраны.
4.1 Метод отбора высоко- и низкоустойчивых животных
Схема, по которой животные тестировались на устойчивость к гипоксии, была разработана проф. Лукьяновой [Лукьянова и др., 1999; Лукьянова, Коробков, 1981]. В работе использовались самцы крыс линии Вистар массой 250-300 г., которых помещали в барокамеру. Группа высокоустойчивых (ВУ) – животные, которые выдерживали острую гипобарическую гипоксию, соответствующую подъему на высоту 11500 м, в течение 10-15 мин. Группа низкоустойчивых (НУ) животных выдерживала эту высоту только в течение 1-1.5 мин.
Глава 5. Результаты и обсуждения
5.1 Параметры функционирования митоКАТФ канала у крыс с различной резистентностью, а также у животных, адаптированных к гипоксии
В этом разделе работы исследовались такие показатели, как дыхание МХ, скорость АТФ-зависимого К+ транспорта, количество К+ в МХ, а также чувствительность этого транспорта к АТФ у крыс с различной резистентностью к гипоксии.
5.1.1 Изучение параметров дыхания и окислительного фосфорилирования в МХ печени и сердца крыс с различной резистентностью к гипоксии
Несмотря на то, что участие митоКАТФ в защите миокарда и других тканей от ишемических повреждений не вызывает сомнений, механизм позитивного действия активаторов этого канала остается неясным. Для изучения этого вопроса в работе исследовались параметры дыхания и окислительного фосфорилирования в МХ печени и сердца крыс с различной устойчивостью к недостатку кислорода, а также у животных, адаптированных к гипоксии.
Изучение параметров дыхания и окислительного фосфорилирования МХ печени и сердца крыс с различной устойчивостью к гипоксии показало, что скорость дыхания МХ во всех метаболических состояниях у высокоустойчивых животных значительно ниже таковой у низкоустойчивых (Рис.5). Следует отметить, что высокоустойчивые животные – это животные, которые выдерживали острую гипобарическую гипоксию, соответствующую подъему на высоту 11500 м, в течение 10-15 мин. Группа низкоустойчивых (НУ) животных выдерживала эту высоту только в течение 1-1.5 мин.
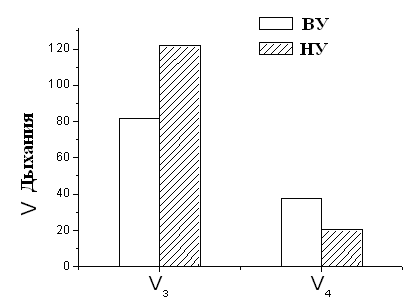
Рисунок 5. Скорость дыхания МХ высоко- и низкоустойчивых к гипоксии
НУ – низкоустойчивые к гипоксии животные, ВУ – крысы, высокоустойчивые к гипоксии. Концентрация белка в кювете – 1-2 мг/мл. Среда инкубации: 5 мМ Tris-HCl, 200 мМ сахарозы, 50 мМ KCl, 5 мМ NaH2PO4, 3 мкМ ротенона, рН 7.2. Эксперименты проводились в закрытой ячейке при постоянном перемешивании и термостатировании при температуре 26°С.
При этом измерение дыхательного контроля времени фосфорилирования АДФ показало, что окислительное фосфорилирование, то есть синтез АТФ происходит более эффективно у высокорезистентных крыс (Рис.6).
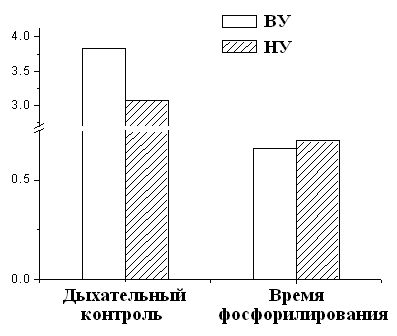
Рисунок 6. Дыхательный контроль и время фосфорилирования МХ крыс с различной устойчивостью к гипоксии
ВУ – высокоустойчивые к гипоксии крысы, НУ – низкоустойчивые к гипоксии животные. Условия как на рис. 7.
Это свидетельствует об исходно меньшей экономичности процесса синтеза АТФ у низкоустойчивых животных. Таким образом, гипоксия, т.е. увеличение функциональной нагрузки на дыхательную цепь МХ при подъеме животных на высоту или при подаче воздуха со сниженной концентрацией кислорода, может привести к истощению резервных возможностей дыхательной цепи, что не происходит у высокоустойчивых животных.
Адаптация низкоустойчивых крыс интервальной нормобарической гипоксией по методу, предложенному в Hypoxia Medical Academy (США), проявляется у них в сопряжении дыхания, что, в свою очередь, выражается в снижении скорости дыхания, увеличении дыхательного контроля и сокращении времени, необходимого для фосфорилирования АТФ (Рис.9).
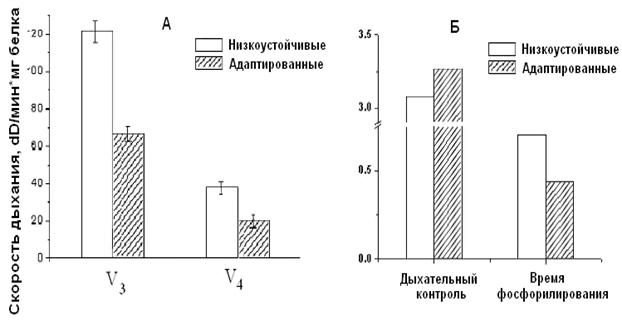 Рисунок 7. Скорость
дыхания (А) и время фосфорилирования (Б) МХ сердца крыс низкоустойчивых и
адаптированных к гипоксии
Рисунок 7. Скорость
дыхания (А) и время фосфорилирования (Б) МХ сердца крыс низкоустойчивых и
адаптированных к гипоксии
Как видно из рис. 7, при адаптации к недостатку кислорода животных низкоустойчивых к гипоксии, скорость дыхания МХ у них уменьшается. Кроме того, у адаптированных крыс сокращается время фосфорилирования и увеличивается значение дыхательного контроля (Рис.9 Б). Эти данные свидетельствуют о возрастании степени сопряженности дыхательной цепи МХ крыс низкоустойчивых к килородному голоданию при гипоксической тренировке.
Следовательно, адаптация приводит к переходу крыс из состояния низкой устойчивости в состояние повышеной устойчивости к гипоксии. Согласно данным Лукьяновой [Лукьянова, 2004] при адаптации крыс гипоксической тренировкой время жизни животного при подъеме на высоту, характеризующее общую неспецифическую резистентность крыс, у НУ животных увеличивается уже после первой тренировки на 120-160% (контроль принят за 0). У НУ время жизни в последующие 20 дней превышает исходную резистентность в 2 раза. У ВУ изменения во времени жизни вообще отсутствуют в первые 7 дней, после чего наблюдается небольшое увеличение, максимум до 40%. В работе делается вывод, что при адаптации гипоксической тренировкой наблюдается экономизация энергетических процессов МХ (Рис. 8).
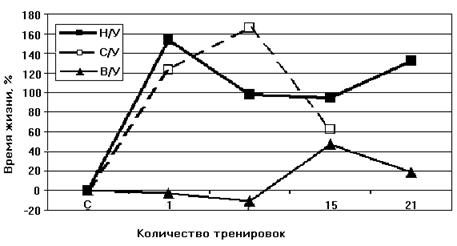
Рисунок 8. Динамика изменения устойчивости к кислородной недостаточности при гипоксической тренировке животных с различной устойчивостью к гипоксии
Н/У – низкоустойчивые крысы, В/У – высокоустойчивые, С/У – животные со средней степенью устойчивости (выдерживающие подъем на высоту в 11500 м в течение 7 минут) [Лукьянова, 2004].
В случае, когда такая оптимизация уже существует, как у высокорезистентных животных, тренировки не приводят к увеличению времени жизни крыс в условиях гипоксии [Лукьянова, 2004]. Поэтому эксперименты по адаптации животных мы проводили на низкоустойчивых к гипоксии крысах.
В работе были определены параметры АТФ-ингибируемого энергоависимого входа К+ в МХ крыс с различной резистентностью к гипоксии, а также низкоусточивых крыс после их адаптации интервальной нормобарической гипоксической тренировкой. Как следует из рисунка 9А, скорость входа К+ в МХ высокоустойчивых крыс существенно выше, чем в МХ низкоустойчивых животных.
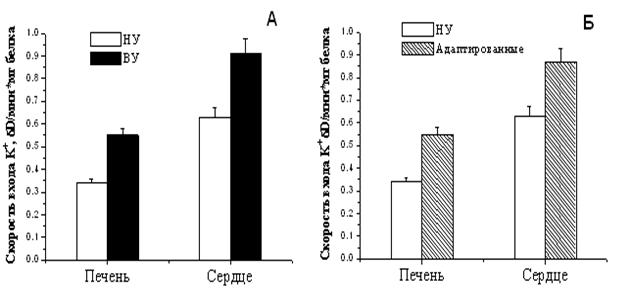 Рисунок 9. Скорость энергозависимого входа
К+ в МХ печени и сердца крыс с различной устойчивостью к гипоксии
(А), а также в МХ животных, адаптированных к гипоксии Б
Рисунок 9. Скорость энергозависимого входа
К+ в МХ печени и сердца крыс с различной устойчивостью к гипоксии
(А), а также в МХ животных, адаптированных к гипоксии Б
НУ – низкоустойчивые, ВУ – высокоустойчивые животные. Концентрация МХ белка в ячейке 0.1 мг/мл. Среда инкубации: 50 мМ KCl, 5 мМ HEPES, 5 мМ NaH2PO4, 5мМ янтарной кислоты, 0.5 мМ MgCl2, 0.1 мМ ЭГТА, 5 мкМ цитохрома С, 2 мкM ротенона, 1 мкМ циклоспорина А, рН 7.2. Набухание инициировали добавлением МХ.
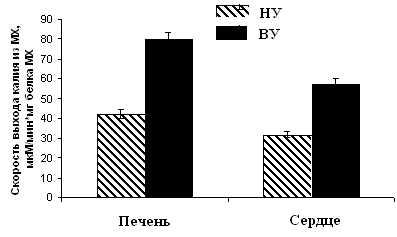
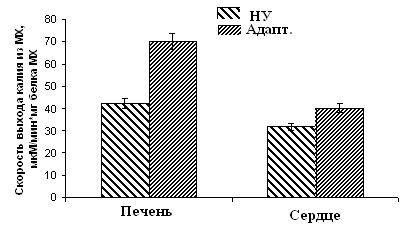
Рисунок 10. Скорость ДНФ-индуцированного выхода ионов К+ из МХ животных высоко-, низкоустойчивых к гипоксии и низкоустойчивых, адаптированных к гипоксии животных
ВУ – высокоустойчивые крысы, НУ – низкоустойчивые, Адапт. – низкоустойчивые, адаптированные к гипоксии. Измерения проводились при постоянном перемешивании и термостатировании при 26°С. Концентрация МХ белка в ячейке составляла 1.5-2 мг/мл. Среда инкубации содержала: 0.3 М сахарозы, 3 мМ NaH2PO4, 10 мМ Трис-HCl, pH 7.4.
Гипоксическая тренировка приводит к увеличению скорости энергозависимого входа К+ до уровня, сравнимого с аналогичными показателями высокорезистентных крыс (Рис.9Б).
Эти данные коррелируют с результатами исследования ДНФ-индуцированного АТФ-зависимого выхода К+ из МХ, измеренного с помощью К+-селективного электрода (Рис. 10).
Следует также отметить, что адаптация приводит к изменению параметров ингибирования канала АТФ. Установлено, что Кi для АТФ в митоКАТФ сердца существенно ниже у адаптированных и высокоустойчивых животных, по сравнению с низкоустойчивыми животными (Таблица 1), что является свидетельством более тонкой регуляции К+ транспорта при адаптации крыс к гипоксии.
Таблица 1. Константа ингибирования АТФ энергозависимого входа К+ в МХ сердца и печени крыс с различной устойчивостью к гипоксии, а также у адаптированных к гипоксии
| Устойчивость к гипоксии |
Ki50, мкМ АТФ |
|
| Сердце | Печень | |
| Высокоустойчивые |
18.06+5.38 |
51.81+18.05 |
| Низкоустойчивые |
26.30+8.55 |
71.69+8.32 |
| Адаптированные |
17.74+9.85 |
35.74+8.81 |
* Различия достоверны с p<0.05.
При увеличении скорости входа калия в МХ следовало ожидать значительного увеличения количества калия в МХ адаптированных животных, что приводило бы к существенному увеличению объема МХ матрикса. Однако концентрация калия в МХ высокоустойчивых и адаптированных к гипоксии крыс не только существенно не изменилась, но даже уменьшилась (Рис.11А, Б). Это означает, что объем МХ не увеличился, и даже немного сократился. Полученные данные указывают на то, что адаптация, по-видимому, приводит не только к интенсификации энергозависимого входа К+, но и к активации К+/Н+-обменника, который регулирует выход ионов калия из МХ.
Выброс калия из МХ при адаптации животных к гипоксии за счет интенсификации К+/Н+-обменника при активации митоКАТФ позволяет поддерживать постоянный объем МХ и, вероятно, необходим для адаптации животных к гипоксии.
Возможно, при адаптации низкоустойчивых животных к гипоксии важное значение имеет активация не только системы АТФ-зависимого входа К+ в мтиохондрии, но и системы выхода этого иона. При этом снижение активности К+/Н+-обменника может быть причиной высокоамплитудного набухания и следующего за ним повреждения МХ при ишемии.
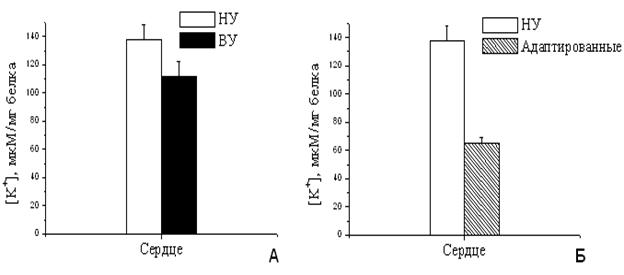 Рисунок 11. Количество К+
в МХ сердца крыс с различной резистентностью (А) и адаптированных к
гипоксии (Б)
Рисунок 11. Количество К+
в МХ сердца крыс с различной резистентностью (А) и адаптированных к
гипоксии (Б)
Измерения проводились при постоянном перемешивании и термостатировании при 26°С. Условия как на рис. 10.
Известно, что при гипоксии недостаток кислорода приводит к восстановлению переносчиков дыхательной цепи, поскольку сток электронов на кислород затруднен [Лукьянова, 2004].
В соответствии с литературными данными восстановление переносчиков, локализованных на I и III комплексах дыхательной цепи, приводит к увеличению образования активных форм кислорода (АФК) [Kaplan-Bresler, 1965; Ferranti et al., 2003]. Как было показано ранее, главным участком образования АФК являются связанные с белком убисемихиноны, которые сопряжены по спину с железо-серным кластером [Ohnishi et al., 2005].
МХ превращают несколько процентов потребляемого кислорода в АФК [Lenaz et al., 2002]. Как было показано ранее, небольшие концентрации АФК необходимы для функционирования дыхательной цепи [Kondrashova and Mironova, 1971]. В то же время, повышенное образование АФК при гипоксии служит основным повреждающим фактором [Starkov et al., 1997; Barger et al., 2002].
Обнаруженная нами активация калиевого цикла, способствует слабому разобщению митохондрий и снижению мембранного потенциала. Известно, что незначительное снижение мембранного потенциала (~13%) ведет к существенному уменьшению продукции АФК (до 80%) [Korshunov et al., 1997]. Кроме того, было установлено, что активация канала сопровождается снижением концентрации АФК в клетке, способствуя сохранению уровня АТФ [Zweier et al., 1987; Pain et al., 2000].
Этот предполагаемый механизм может объяснить защитную роль митоКАТФ канала при реперфузии. Хорошо известно, что АФК являются основным повреждающим фактором при ишемии/реперфузии [Pearlstein et al., 2002; Li et al., 2002], а активация митоКАТФ канала приводит к сокращению уровня образования АФК во время фазы реперфузии [Zweier et al., 1987; Ozcan et al., 2002]. Полученные данные подтверждают развиваемую в лаборатории проф. Лукьяновой концепцию, что адаптация к гипоксии идет на фоне снижения свободнорадикальной активности, а не ее увеличения [Лукьянова, 2004].
Таким образом, полученные в работе результаты позволили доказать важную роль митоКАТФ в формировании устойчивости организма к кислородному голоданию, а также в адаптации животных к гипоксии. В работе предлагается также возможный механизм формирования такого типа адаптации.
5.2 Изучение структурной организации митохондриального АТФ-зависимого калиевого канала
Изучение структурной организации митоКАТФ, учитывая его существенную физиологическую роль, особенно при гипоксии, является актуальной проблемой. Как было сказано в «Обзоре литературы», японские ученые полагают, что по структуре он близок к цитоплазматическому каналу [Suzuki et al., 1997]. Однако, проведенный в лаборатории проф. Гарлида анализ действия АТ к цито-KIR на АТФ-зависимый транспорт К+ в МХ не подтвердил эти данные [Grover and Garlid, 2000]. С другой стороны, в группе проф. Марбана было высказано предположение о том, что канал образован мультикомплексом, сосоящим из 5 МХ белков, одним из которых является АВС [Ardehali et al., 2004].Следовательно, структурная организация МХ АТФ-зависимого калиевого канала до настоящего времени окончательно не выяснена.
5.2.1 Определение гомологии белка с м.м. 55 кДа методом MS-MALDI-TOF/TOF
Первым этапом изучения белка с м.м. 55 кДа было определение гомологичности его структуры последовательностям известных белков. Для этого электрофоретически чистый белок исследовали MS-MALDI-TOF/TOF (от англ. mass spectrometry-matrix assisted laser desorbtion/ionization – time of flight/time of flight) анализом.
Согласно данным, полученным MS-MALDI-TOF/TOF анализом, белок с м.м. 55 кДа на 54% гомологичен белку-предшественнику, который, исходя из результатов анализа базы данных NCBI (программное обеспечение - MASCOT (MartixScience, Москва)), является предшественником кальретикулина. Вероятно, белок с м.м. 55 кДа является конечным продуктом систем посттрансляционной модификации данного белка-предшественника. На рисунке 14 представлена аминокислотная последовательность белка-предшественника. Последовательности данного белка, перекрывающиеся с последовательностями 55 кДа белка, выделены серым цветом.
1 MLLSVPLLLG LLGLAAADPA IYFKEQFLDG DAWTNRWVES KHKSDFGKFV
51 LSSGKFYGDQ EKDKGLQTSQ DARFYALSAR FEPFSNKGQT LVVQFTVKHE
101 QNIDCGGGYV KLFPGGLDQK DMHGDSEYNI MFGPDICGPG TKKVHVIFNY
151 KGKNVLINKD IRCKDDEFTH LYTLIVRPDN TYEVKIDNSQ VESGSLEDDW
201 DFLPPKKIKD PDAAKPEDWD ERAKIDDPTD SKPEDWDKPE HIPDPDAKKP
251 EDWDEEMDGE WEPPVIQNPE YKGEWKPRQI DNPDYKGTWI HPEIDNPEYS
301 PDANIYAYDS FAVLGLDLWQ VKSGTIFDNF LITNDEAYAE EFGNETWGVT
351 KAAEKQMKDK QDEEQRLKEE EEDKKRKEEE EAEDKEDEDD RDEDEDEEDE
401 KEEDEEDATG QAKDEL
Рис.12. Аминокислотная последовательность прекурсорного белка. Участки структуры белка-предшественника, совпадающие с последовательностями, имеющимися в белке с м.м. 55 кДа, выделены серым цветом
При рассмотрении структуры типичного кальретикулина, выделенного из печени крысы, процент перекрывания его аминокислотных последовательностей с известными последовательностями 55 кДа белка также оказался достаточно большим (Рис.13).
1 mllsvplllg llglaaadpa iyfkeqfldg dawtnrwves khksdfgkfv
51 lssgkfygdq ekdkglqtsq darfyalsar fepfsnkgqt lvvqftvkhe
101 qnidcgggyv klfpggldqk dmhgdseyni mfgpdicgpg tkkvhvifny
151 kgknvlinkd irckddefth lytlivrpdn tyevkidnsq vesgsleddw
201 dflppkkikd pdaakpedwd erakiddptd skpedwdkpe hipdpdakkp
251 edwdeemdge weppviqnpe ykgewkprqi dnpdykgtwi hpeidnpeys
301 pdaniyayds favlgldlwq vksgtifdnf litndeayae efgnetwgvt
351 kaaekqmkdk qdeeqrlkee eedkkrkeee eaedkededd rdededeede
401 keedeedatg qakdel
Рисунок 13. Аминокислотная последовательность типичного кальретикулина (21-332 – кальретикулин, 1-17 – сигнальная последовательность, удаляемая протеолизом при созревании белка). Участки последовательности, общие с белком с м.м. 55 кДа, выделены серым цветом
Классический кальретикулин входит в состав семейства высококонсервативных белков с м.м. около 55 кДа, локализующихся как в саркоплазматическом, так и в эндоплазматическом ретикулуме клеток печени, скелетной и гладкой мускулатуры, сердечной мышцы [Fliegel et al., 1989]. Белки этого семейства связывают ионы кальция, цинка, других металлов, сахара, нуклеотидфосфаты, в частности, УДФ. Они также выступают в роли шаперонных белков в процессе фолдинга, участвуют в системе белковой машинерии, регуляции апоптоза, мейоза, экспорта белков из ядра клетки. Известны гомологи гена кальретикулина у мыши, крысы и человека. У крысы гомологичный ген кальретикулина локализован в 19 хромосоме. При этом ранее в нашей лаборатории было показано, что при окрашивании белков в геле после ДДС-ПААГ электрофореза по Шиффу, исследуемый белок с м.м. 55 кДа давал положительную реакцию, что говорит о способности его связывать сахара [неопубликованные данные]. Кроме того, определялось также и сродство белка-канала к кальцию с использованием 45Ca [неопубликованые данные]. Было показано, что исследуемый белок с м.м. 55 кДа проявляет достаточно большое сродство к этому иону. Эти результаты согласуются с данными по взаимодействию кальретикулина с сахарами и кальцием.
ИНТЕРЕСНОЕ
© 2009 Все права защищены. |