 | |
МЕНЮ
- Главная
- Языкознание филология
- Финансовые науки
- Управленческие науки
- Товароведение
- Технология
- Теплотехника
- Теория организации
- Теория государства и права
- Таможенная система
- Схемотехника
- Строительство
- Страхование
- Статистика
- Религия и мифология
- Психология и педагогика
- Промышленность производство
- Медицинские науки
- Медицина
- Краеведение и этнография
- Компьютерные науки
- История
- Искусство и культура
- Информатика
- Инвестиции
- Издательское дело и полиграфия
- Зоология
- Журналистика
- Естествознание
- Деньги и кредит
- Делопроизводство
- Гражданское право и процесс
- Государство и право
- Геополитика
- Геология
- Геодезия
- География
- Военная кафедра
- Ветеринария
- Валютные отношения
- Бухгалтерский учет и аудит
- Ботаника и сельское хоз-во
- Биржевое дело
- Биология и химия
- Биология
- Безопасность жизнедеятельности
- Банковское дело
- Астрономия
- Астрология
- Архитектура
- Арбитражный процесс
- Административное право
- Авиация и космонавтика
- Карта сайта
Реферат: Производство серной кислоты
Срок службы катализатора не менее 4 лет.
8. Термодинамический анализ
Расчет теплового эффекта реакции окисления SO2 в SO3:
2SO2 + O2 = 2 SO3
![]() кДж
кДж
Q=-ΔН=196,6 кДж
Реакция экзотермическая – протекает с выделением тепла.
ΔS=![]()
ΔG=ΔH-TΔS=-196,6-298*17,66=-5459,28
Энергия Гиббса значительно меньше нуля. Это значит, что реакция термодинамически возможна.
Расчет теплового эффекта реакции конденсации SO3:
SO3 + H2O = H2SO4
![]() кДж
кДж
Q=-ΔН=174,26 кДж
Реакция экзотермическая- протекает с выделением тепла.
ΔS=![]() Дж
Дж
ΔG=ΔH-TΔS=-174,26-298*-288,07=-86019,12
Энергия Гиббса значительно меньше нуля. Это значит, что реакция термодинамически возможна.
Таблица 1
Значения термодинамических величин
|
2SO2 + O2 = 2 SO3 |
|
| ΔН | -196,6 кДж |
| ΔS | 17,66 |
| Q | 196,6 |
| ΔG | -5459,28 |
Таблица 2
Значения Кр для реакции окисления SO2 при различных температурах
|
Температура, 0С |
Температура, К | Константа равновесия, Кр |
| 400 | 673 | 539,4 |
| 450 | 723 | 158,0 |
| 500 | 773 | 55,5 |
| 550 | 823 | 22,2 |
| 600 | 873 | 9,8 |
Вывод: реакция окисления SO2 наиболее полно протекает при невысоких температурах. Из этого следует, реакцию окисления SO2 целесообразно проводить при невысоких температурах. Повышение давления, по принципу Ле-Шателье, влияет положительно.
9. Кинетика процесса окисления диоксида серы
Константа скорости реакции: определяется из уравнения Аррениуса.
К=К0*е(-Еа/RT)=9,3*105*е(-79000/430*8,31)=0,13
Еа- энергия активации (79000Дж/моль)
R- газовая постоянная (8,31)
Е- температура
К0 – предэкспоненциальный множитель (9,3*105сек)
Расчет равновесной степени превращения
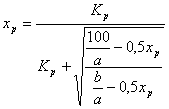
Таблица 3
Значения равновесной степени превращения при разных температурах
|
T, 0C |
T, K | Kp |
xp % |
| 100 | 373 | 8,78 | 99,99 |
| 200 | 473 | 5,9 | 98,82 |
| 300 | 573 | 4,04 | 94,47 |
| 400 | 673 | 2,72 | 86,54 |
| 500 | 773 | 1,74 | 79,23 |
Таблица 4
Значения равновесной степени при различном содержании О2 и SO2 в газовой смеси
|
Т, оС |
Содержание О2 |
Содержание SO2 |
хр |
| 400 | 4 | 12 | 98,57 |
| 6 | 12 | 93,29 | |
| 8 | 12 | 86,57 |
Исходя из полученных данных таблиц 3 и 4, можно сделать следующий вывод: с точки зрения равновесной степени превращения, процесс окисления диоксида серы нужно вести при низком содержании SO2 в газовой смеси и при низких температурах.
Расчет времени контактирования газовой смеси в контактном аппарате
Для того, чтобы рассчитать время контактирования, разделим слой катализатора на 5 частей.
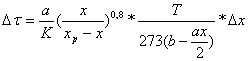
Таблица 5
Время контактирования газа на первом слое катализатора
| № слоя | a | b | t | τ, сек |
| 1 | 4 | 12 | 430 | 0,362 |
| 2 | 4 | 12 | 0,827 | |
| 3 | 4 | 12 | 0,407 | |
| 4 | 4 | 12 | 0,752 | |
| 5 | 4 | 12 | 0,84 |
τ = ∑Δτ =3,188 сек
Общее время контактирования на первом слое котализатораτ =3,188 сек.
Таблица 5
Время контактирования газа на втором слое катализатора
| № слоя | a | b | t | τ, сек |
| 1 | 4 | 12 | 400 | 0,953 |
| 2 | 4 | 12 | 1,124 | |
| 3 | 4 | 12 | 1,352 | |
| 4 | 4 | 12 | 1,448 | |
| 5 | 4 | 12 | 1,503 |
τ = ∑Δτ =6,38 сек
Расчет увеличения температуры
Тк= Тн + λΔх=787,26 К
Тн, Тк –начальная и конечная температуры, К
λ –коэффициент повышения температуры газа при изменении степени превращения на 1 % в адиабатических условиях
Δх – повышение степени превращения
10. Конденсация серной кислоты
ИНТЕРЕСНОЕ
© 2009 Все права защищены. |