 | |
МЕНЮ
- Главная
- Языкознание филология
- Финансовые науки
- Управленческие науки
- Товароведение
- Технология
- Теплотехника
- Теория организации
- Теория государства и права
- Таможенная система
- Схемотехника
- Строительство
- Страхование
- Статистика
- Религия и мифология
- Психология и педагогика
- Промышленность производство
- Медицинские науки
- Медицина
- Краеведение и этнография
- Компьютерные науки
- История
- Искусство и культура
- Информатика
- Инвестиции
- Издательское дело и полиграфия
- Зоология
- Журналистика
- Естествознание
- Деньги и кредит
- Делопроизводство
- Гражданское право и процесс
- Государство и право
- Геополитика
- Геология
- Геодезия
- География
- Военная кафедра
- Ветеринария
- Валютные отношения
- Бухгалтерский учет и аудит
- Ботаника и сельское хоз-во
- Биржевое дело
- Биология и химия
- Биология
- Безопасность жизнедеятельности
- Банковское дело
- Астрономия
- Астрология
- Архитектура
- Арбитражный процесс
- Административное право
- Авиация и космонавтика
- Карта сайта
Учебное пособие: Инфракрасная спектроскопия и спектроскопия кругового дихроизма. Методы определения вторичной структуры белков
Для применения данного метода к анализу спектров КД произвольных
белков необходимо, чтобы анализируемый спектр также быть снят в диапазоне от 178
до 260 нм. Поскольку при его аппроксимации базисными спектрами рассматривается лишь
небольшой их набор, то проблемы, связанной с неустойчивостью метода наименьших квадратов,
не возникает. Однако, очевидно, что приемлемые результаты возможно получить только
в том случае, если структурные характеристики исследуемого белка достаточно хорошо
представлены среди базисных белков. Для установления достоверности полученных результатов
авторы метода рекомендуют использовать метод наименьших квадратов без ограничений
на коэффициенты разложения (смотри условия (1.2.2)). При этом большие по модулю
отрицательные коэффициенты ![]() или большое отклонение их суммы от
единицы свидетельствуют о том, что метод в данном случае неприменим. Подробнее об
этом критерии будет говориться в следующем разделе.
или большое отклонение их суммы от
единицы свидетельствуют о том, что метод в данном случае неприменим. Подробнее об
этом критерии будет говориться в следующем разделе.
Метод "выбора переменных" [7]. Обычный метод наименьших квадратов, используемый для представления произвольного спектра КД в виде линейной комбинации базисных спектров, имеет по сравнению с другими методами наибольшую гибкость. Это проявляется в том, что спектры базисных белков участвуют в разложении в различной степени в зависимости от характера конкретного спектра. Однако, эксперименты показывают, что наилучшее воспроизведение формы спектра не всегда дает лучшие результаты. Более того, метод наименьших квадратов оказывается неустойчивым к экспериментальной ошибке, если число используемых в разложении базисных спектров превышает информационное содержание анализируемого спектра (для спектров в диапазоне 178-260 нм оно приблизительно равно пяти, а в диапазоне 190-260 нм - четырем).
Метод "регуляризации" [4] решает эту проблему с помощью "регуляризатора", который стабилизирует систему, оставляя ей при этом значительную гибкость. Метод "ортогональных спектров" [5,6] достигает устойчивости метода наименьших квадратов за счет использования только пяти ортогональных базисных спектров, построенных на основе исходного набора спектров базисных белков. Однако, поскольку базисные спектры построены на основе фиксированного набора спектров базисных белков, степень участия последних при воспроизведении анализируемого спектра также оказывается в некоторой мере фиксированной, а гибкость метода - крайне низкой.
Метод "выбора переменных", суть которого будет описана ниже, основан на методе "ортогональных спектров", но обладает значительной гибкостью, достигаемой за счет использования при построении ортогональных базисных спектров различных наборов базисных белков, выбираемых с помощью статистической процедуры "выбора переменных". Рассмотрим смысл этой процедуры более подробно.
Предсказание вторичной структуры белка по его спектру КД должно удовлетворять двум важным условиям:
1.
Величины содержания в белке рассматриваемых структурных элементов не должны
быть отрицательными: ![]() .
.
2.
Суммарное содержание в белке всех рассматриваемых типов структур должно быть
равно единице (100%): ![]() .
.
Второе условие является особенно важным при анализе конформационных
изменений белка при денатурации или связывании каких-либо лигандов. Во всех методах,
описанных выше, оба эти условия вводятся непосредственно в процедуру нахождения
коэффициентов ![]() с помощью метода наименьших квадратов.
Однако такое ограничение на коэффициенты может весьма заметным образом исказить
результаты этой процедуры.
с помощью метода наименьших квадратов.
Однако такое ограничение на коэффициенты может весьма заметным образом исказить
результаты этой процедуры.
Для преодоления подобных недостатков авторы рассматриваемого
метода не пользуются условиями (1) и (2) и допускают существование отрицательных
коэффициентов ![]() и отклонение их суммы от единицы.
Появление подобных несоответствий свидетельствует о неуспехе метода и может быть
объяснено наличием у некоторых базисных белков таких структурных форм, вкладов которых
в спектр исследуемого белка не было обнаружено. Для избежания подобных ситуаций
вводится процедура "выбора переменных", которая поочередно исключает белки
из исходного базисного набора, а затем проводит вычисления с каждой из полученных
комбинаций базисных белков, используя метод "ортогональных спектров".
Эксперименты показали, что достоверность результатов значительно повышается по мере
того, как сумма коэффициентов
и отклонение их суммы от единицы.
Появление подобных несоответствий свидетельствует о неуспехе метода и может быть
объяснено наличием у некоторых базисных белков таких структурных форм, вкладов которых
в спектр исследуемого белка не было обнаружено. Для избежания подобных ситуаций
вводится процедура "выбора переменных", которая поочередно исключает белки
из исходного базисного набора, а затем проводит вычисления с каждой из полученных
комбинаций базисных белков, используя метод "ортогональных спектров".
Эксперименты показали, что достоверность результатов значительно повышается по мере
того, как сумма коэффициентов ![]() приближается к единице. Повышение
точности анализа было достигнуто даже при анализе спектров в укороченном диапазоне
(190-260 нм).
приближается к единице. Повышение
точности анализа было достигнуто даже при анализе спектров в укороченном диапазоне
(190-260 нм).
Поскольку заранее не известно, какие из базисных белков содержат
элементы, отсутствующие у исследуемого белка, и спектры которых необходимо исключить
из исходного набора для улучшения результатов, рассматриваются все возможные комбинации
из исходного набора 16 базисных спектров. Эта процедура выполняется в следующем
порядке. Сначала из исходного набора исключаются поочередно по три базисных спектра
на каждом шаге, а ортогональные базисные спектры строятся на основе оставшихся 13
исходных базисных спектров. Сравнение результатов, полученных для различных наборов
из 13 базисных белков, выявляет один или два белка, которые являлись причиной отклонений
коэффициентов ![]() и их суммы от условий (1) и (2). Эти
белки исключаются из исходного набора, и процедура повторяется до тех пор, пока
не будут получены удовлетворительные результаты.
и их суммы от условий (1) и (2). Эти
белки исключаются из исходного набора, и процедура повторяется до тех пор, пока
не будут получены удовлетворительные результаты.
Критериями удовлетворительного решения, соответствующего оптимальному набору базисных спектров, являются следующие условия:
1.
Сумма коэффициентов ![]() должна находиться в диапазоне от 0.96
до 1.05 (или, по крайней мере, от 0.90 до 1.10).
должна находиться в диапазоне от 0.96
до 1.05 (или, по крайней мере, от 0.90 до 1.10).
2.
Значение содержания произвольной структурной формы в исследуемом белке (![]() ) должно быть выше
- 0,05.
) должно быть выше
- 0,05.
3. Воспроизведение анализируемого спектра на основе выбранного набора базисных спектров должно быть лучше, чем при использовании полного их набора.
4. Более предпочтительным является набор, содержащий большее число базисных спектров.
5. Более предпочтительными являются те белки, спектры которых ближе к анализируемому спектру.
На практике в большинстве случаев удовлетворительных результатов удается достичь при исключении из исходного набора всего трех или четырех белков, причем среднеквадратичная ошибка при воспроизведении анализируемого спектра составляет меньше 0.2 единицы De. Если несколько наборов базисных белков оказываются удовлетворительными в одинаковой степени, то результаты, полученные на их основе, усредняются.
В заключение можно отметить, что метод "выбора переменных" является мощным средством анализа спектров КД белков в ситуациях, когда другие распространеннные методы дают заведомо неверные результаты.
Сравнение различных методов анализа спектров КД.Поскольку все методы анализа спектров КД имеют чисто эмпирический характер, каждый из них нуждается в экспериментальной проверке на белках с известными рентгеноструктурными данными. Обычно подобная проверка проводится на белках, включенных в базисный набор для данного метода. При этом белки поочередно исключаются по одному из этого набора, а их спектры анализируются на основе спектров оставшихся белков. После этого результаты, полученные для каждого типа вторичной структуры, сравниваются со значениями, полученными при рентгеноструктурном анализе, с помощью подсчета коэффициента корреляции между этими двумя наборами данных, определяемого следующим выражением:
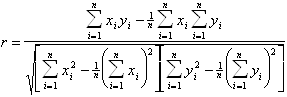 .(1.2.22)
.(1.2.22)
Здесь ![]() и
и ![]() - экспериментальный и рассчитанный
наборы данных, n - число белков в базисном наборе. Значения коэффициента корреляции
r лежат в диапазоне от - 1 до 1, причем значеия r, близкие к 1, свидетельствуют
об успешном предсказании, характеризующимся достаточно высокой точностью. Значения
r, близкие к 0 или - 1, говорят о случайном совпадении или полном несоответствии
рассчитанных и экспериментальных данных.
- экспериментальный и рассчитанный
наборы данных, n - число белков в базисном наборе. Значения коэффициента корреляции
r лежат в диапазоне от - 1 до 1, причем значеия r, близкие к 1, свидетельствуют
об успешном предсказании, характеризующимся достаточно высокой точностью. Значения
r, близкие к 0 или - 1, говорят о случайном совпадении или полном несоответствии
рассчитанных и экспериментальных данных.
Ниже приведены значения коэффициентов корреляции для четырех рассмотренных методов: метода "эталонных спектров" [2,3], метода "регуляризации" [4], метода "ортогональных спектров" [5,6] и метода "выбора переменных" [7]:
| метод | диапазон, | коэффициент корреляции r | |||||
| нм | a | b ¯ | b | b ¯+ | b-изг. | Ост. | |
| [2,3] | 190-240 | 0.85 | - | - | 0.25 | -0.31 | 0.46 |
| [4] | 190-240 | 0.96 | - | - | 0.94 | 0.31 | 0.49 |
| [5,6] | 190-260 | 0.98 | 0.40 | 0.00 | -0.27 | 0.18 | 0.24 |
| [7] | 190-260 | 0.95 | 0.57 | 0.47 | 0.45 | 0.54 | 0.69 |
| [4] | 178-260 | 0.96 | 0.23 | 0.39 | 0.12 | 0.51 | 0.64 |
| [5,6] | 178-260 | 0.98 | 0.55 | 0.63 | 0.54 | 0.30 | 0.61 |
| [7] | 178-260 | 0.97 | 0.78 | 0.67 | 0.76 | 0.49 | 0.86 |
Пакет программ STRUCTURE разработан в институте белка РАН (1991-1992 К.С. Василенко). Он предназначен для анализа спектров кругового дихроизма белков и определения их вторичной структуры. Алгоритм анализа спектров основан на методах, описанных выше. Пакет STRUCTURE состоит из следующих программ и вспомогательных файлов:
ИНТЕРЕСНОЕ
© 2009 Все права защищены. |