 | |
МЕНЮ
- Главная
- Языкознание филология
- Финансовые науки
- Управленческие науки
- Товароведение
- Технология
- Теплотехника
- Теория организации
- Теория государства и права
- Таможенная система
- Схемотехника
- Строительство
- Страхование
- Статистика
- Религия и мифология
- Психология и педагогика
- Промышленность производство
- Медицинские науки
- Медицина
- Краеведение и этнография
- Компьютерные науки
- История
- Искусство и культура
- Информатика
- Инвестиции
- Издательское дело и полиграфия
- Зоология
- Журналистика
- Естествознание
- Деньги и кредит
- Делопроизводство
- Гражданское право и процесс
- Государство и право
- Геополитика
- Геология
- Геодезия
- География
- Военная кафедра
- Ветеринария
- Валютные отношения
- Бухгалтерский учет и аудит
- Ботаника и сельское хоз-во
- Биржевое дело
- Биология и химия
- Биология
- Безопасность жизнедеятельности
- Банковское дело
- Астрономия
- Астрология
- Архитектура
- Арбитражный процесс
- Административное право
- Авиация и космонавтика
- Карта сайта
Курсовая работа: Методика определения и показатели устойчивости бактерий к дезинфеткантам
На выборках больничных и внебольничных штаммов энтеробактерий, псевдомонад и стафилококков кроме МБК испытан комплекс показателей, предложенный ранее для оценки чувствительности бактерий к антисептикам. Опираясь на полученные при этом результаты, мы рекомендуем для практических целей следующие показатели:
Для получения МБК испытывают ряд разведений дезинфектанта, минимальная концентрация которого не оказывает бактерицидного действия ни на один штамм, а максимальная - подавляет все штаммы. За МБК принимается минимальная концентрация дезинфектанта (в граммах на 100 мл), которая вызывает гибель всех присутствующих в стандартизованной дозе бактерий за 10-минутную экспозицию. Если МБК равна или выше рабочей концентрации дезинфектанта, культура оценивается как устойчивая, если меньше - как чувствительная. Методика определения МБК требует затраты большого количества времени, дезинфектантов и сред, поэтому в практических целях может применяться в особых случаях [2].
2. Показатель клинической устойчивости. В качестве дифференцирующей (клинически устойчивые и клинически чувствительные культуры) взята рабочая концентрация (рекомендуемая для практической дезинфекции) препарата. Культуры, погибающие при 10-минутном воздействии такой концентрации (не растущие при посеве на питательные среды), относят к клинически чувствительным; культуры, которые остаются живыми (дают рост на средах) - к клинически устойчивым. Поскольку в практике дезинфекции, как правило, не учитывают различия в уровнях видовой чувствительности, дифференцирующие уровни при определении клинической устойчивости одинаковы по отношению ко всем видам бактерий, но различны для каждого дезинфицирующего препарата. В тех случаях, когда на практике рекомендуется использовать несколько концентраций, например в зависимости от требуемой степени дезинфекции, мы рекомендуем определять устойчивость выделенных из биотопа культур к рекомендуемой для него концентрации дезинфектанта.
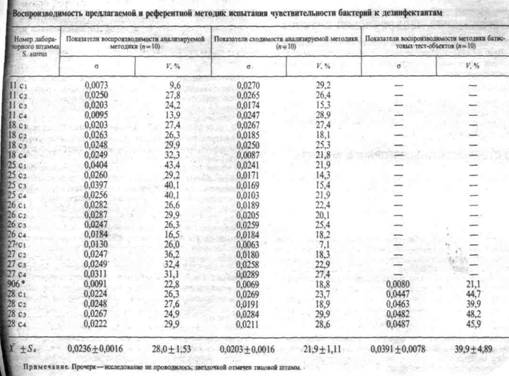
Лучшие результаты при определении клинической устойчивости дала бы ориентация не на вносимую на объект концентрацию, а на концентрацию, которая создается после внесения дезинфектанта. Однако такой подход пока не реален. Показатель клинической устойчивости дает врачу необходимую для эффективной дезинфекции информацию и в то же время доступен бактериологическим лабораториям больниц и санэпидстанций. Поэтому мы рекомендуем его в качестве основного.
3. Показатель биологической (статистической) устойчивости. Клиническая устойчивость отражает высокий уровень устойчивости. Однако в случаях постепенного нарастания признака устойчивости в популяциях бактерий, как показали наши исследования, часто обнаруживаются культуры, которые относятся к клинически чувствительным, но с биологических позиций не могут быть признаны таковыми, поскольку выходят из статистического ряда чувствительных культур. Это наблюдение позволило нам ввести показатель биологической устойчивости к дезинфектантам, дифференцирующей концентрацией которого является средняя величина МБК с двумя квадратическими отклонениями (Х±2о) для выборки в 100 культур из биотопа, в который не вносился дезинфектант. Ценность этого показателя состоит в том, что он дает более раннюю и полную информацию о сдвигах в чувствительности популяции к дезинфектантам, иногда еще до появления клинически устойчивых культур. Это позволяет изменить режим дезинфекции на более раннем этапе. Концентрации дезинфектантов, дифференцирующие биологически чувствительные и устойчивые культуры, специфичны для каждого дезинфектанта и для каждого вида бактерий. Их находят опытным путем.
4. Индекс активности дезинфектанта (ИАД). Показатель клинической устойчивости дает качественную оценку чувствительности культуры (чувствительная, устойчивая) или дезинфектанта (активен, неактивен), что затрудняет выбор более активного дезинфектанта. Количественную оценку можно сделать с помощью предлагаемого нами ИАД, который представляет собой отношение рабочей концентрации дезинфектанта к его МБК для конкретной культуры или Х±2а для популяции, вида или группы близкородственных по признаку чувствительности видов бактерий. Чем выше эта величина, тем более чувствительна культура или активен дезинфектант. Показатель ниже единицы указывает на устойчивость культуры или неэффективность дезинфектанта.
Для исследовательских целей ценная дополнительная информация о чувствительности (устойчивости) бактерий к дезинфектантам может быть получена при построении графика распределения индивидуальных МБК в системе абсцисса- ордината, расчете амплитуды индивидуальных МБК, определении частоты, уровней и спектров устойчивости.
Описанная в статье методика и показатели с положительными результатами опробованы на выборках из больничных и внебольничных популяций стафилококков, псевдомонад и энтеробактерий, что позволяет рекомендовать их для использования в практической медицине и Научных исследованиях.
2.2 Методика, основанная на применении цветной питательной среды, больших доз бактерий и пластмассовых пластин с луночками
Применение цветной питательной среды, больших доз бактерий и пластмассовых пластин с луночками является основой ускоренного и упрощенного способа определения антибактериальной активности дезинфекционных средств. Учет результатов испытания активности дезинфекционных средств опирается на регистрацию изменения цвета питательной среды после термостатирования смесей раствора дезинфекционного средства и взвеси бактерий, а также на учете мутности в лунках пластины.
Разработанная методика позволяет не только оценивать антибактериальную активность большинства дезинфекционных средств, но и определять устойчивость бактериальных культур (в том числе госпитальных) к дезинфекционным средствам.
В последние годы стали появляться сообщения, в которых приведены факты появления устойчивости бактериальных культур к дезинфекционным средствам. Авторы этих работ убеждены, что устойчивость бактерий к дезинфектантам широко распространена среди госпитальных штаммов, в связи с чем необходим мониторинг этого явления. Но в этом случае следует обладать методиками, которые позволили бы изучать выделенные в ЛПУ и других объектах штаммы в широком ассортименте, в то время как существующие методы громоздки и трудоемки.
Для определения антибактериальной активности дезинфекционных средств последние титровали в плоскодонных луночках стерильных пластинок типа Titerteck, предназначенных изначально для иммуноферментного анализа. Разведения дезинфекционных средств, как и приготовление взвеси бактериальных культур осуществляли с помощью цветной питательной среды. Учет результатов вели после термостатирования при 37°С по изменению исходного цвета питательной среды и появлению мутности, которые регистрировали визуально, но возможен учет инструментальный в аппарате типа Multiscan при использовании фильтра 450 nm.
Методика основана на хорошо известном факте, что по мере роста в цветной питательной среде бактерии сдвигают рН в кислую сторону, что влечет за собой изменение цвета среды, а эффективное дезинфекционное средство, по нашему предположению, должно предотвращать конверсию цвета. Работу начали с испытания роста некоторых эталонных штаммов бактерий в питательных средах, в состав которых входили разные индикаторы - феноловый красный, бромкрезолпурпур или бромтимоловый синий. Наиболее яркий переход от исходного цвета к желтому получили при использовании питательной среды с бромкрезол-пурпуром, но наиболее чувствительной к конверсии цвета оказалась зеленая питательная среда с бромтимоловым синим.
Чем выше концентрация бактерий, тем скорее наступает конверсия цвета, которая оказалась необратимой. Из трех индикаторов мы выбрали бромтимоловый синий, концентрация которого в среде составила 0,002%. Что касается концентрации бактерий, то мы остановились на дозе 5*107 м. кл. в луночке. При этой концентрации достаточно было 2-3 генераций бактерий, чтобы наступила конверсия цвета питательной среды в желтый [13; С. 21].
Однако не все виды бактерий меняют цвет среды на желтый. При внесении в питательную среду Ps.alcaligenes уже через 3 часа цвет питательной среды меняется на светлосиний, свидетельствующий не о снижении, а о повышении рН. Однако с увеличением времени светлосиний цвет под влиянием роста бактерий постепенно меняется на желтый. Поэтому в случае синегнойной палочки учет следует вести по перемене зеленого цвета на синий. Трудности возникли и с некоторыми дезинфекционными средствами, которые сами по себе изменяли цвет питательной среды. В качестве примера приводим результаты испытания средства "Септабик" (30% четвертичного аммониевого основания и 65% мочевины). Это средство применяют в концентрациях 2-0,2% по препарату [3; С. 65]. Но в концентрации 1-2% "Септабик" обесцвечивает питательную среду и даже в концентрации 0,5% искажает ее исходный цвет. Поэтому испытывать действие "Септабика" на бактериальные культуры следует при концентрациях средства ниже 0,5%.
Все дезинфекционные средства можно в интересующем нас плане разбить на три группы, руководствуясь рН: кислые, нейтральные и щелочные. Кислые препараты характеризуются тем, что сразу же после добавления к питательной среде меняют цвет на желтый. Испытывать такие препараты можно лишь, начиная с тех концентраций, которые не искажают исходный цвет питательной среды. Аналогичным образом щелочные препараты затруднительно использовать из-за того, что сразу после добавления меняют цвет питательной среды на светло-синий. Гораздо проще обстоит дело с нейтральными дезинфекционными средствами, которые будучи добавленными к питательной среде, не искажают ее исходный цвет. В этих случаях сохранение исходного цвета свидетельствует о губительном действии дезинфекционного средства на бактерии, а изменение цвета на желтый является указанием на то, что препарат не препятствует росту бактерий, если последние не подщелачивают среду. К нейтральным дезинфекционным препаратам можно отнести хлорамин, для которого характерна слабощелочная рН.
Относительно высокие концентрации перекиси водорода обесцвечивали питательную среду. К тому же сразу после добавления к раствору Н2О2 бактерий начиналось обильное выделение пузырьков, обязанное каталазе, которую выделяют многие бактерии. Образование пены затрудняло учет испытаний.
На примере трех дезинфекционных препаратов - "Септабик", хлорамин, перекись водорода - можно убедиться в том, что для каждого средства следует учитывать особенности применения предлагаемой ускоренной и упрощенной методики.
Не всегда рекомендованные в практике концентрации дезинфекционных средств могут быть испытаны с помощью предлагаемой методики, но не исключает ее использование в этих случаях при более низких концентрациях, например, для сравнительных испытаний.
Избранная концентрация бактерий 5-107 м. клеток не влияла на исходный цвет питательной среды и не создавала мутности. Во время термостатирования при 37°С в лунках по мере размножения бактерий легкая мутность появляется к 4 часам для хорошо натренированного глаза. Лишь через 6 часов при 37°С мутность не вызывает сомнений. Можно поступить иначе - после 4-часовой экспозиции при 37°С оставить пластины при комнатной температуре и осуществить учет мутности на следующий день. Прибавление дезинфекционного средства к смеси бактерий и питательной среды препятствует образованию мутности и этот признак может быть использован для оценки антибактериальной активности дезинфекционных средств. В редких случаях мутность в растворе образуется не за счет бактерий, а за счет взаимодействия дезинфектанта с ингредиентами питательной среды, но это наступает сразу после смешения (Дезэффект, Бромосепт).
Итак, представленная в настоящей работе методика упрощенного и ускоренного определения антибактериальных свойств дезинфекционных средств основана на учете двух признаков - изменение цвета питательной среды и появления мутности. Изменение цвета наступает раньше и может быть учтено уже через несколько часов, но имеет ряд ограничений. Появление мутности наступает позднее, но зато лишено ряда ограничений, свойственных цветовому учету. Сочетание двух перечисленных признаков позволяет характеризовать предлагаемую методику оценки антибактериальных качеств дезинфекционных средств как упрощенную и ускоренную.
Техническое исполнение предлагаемой методики укладывается в несколько операций. Вначале готовят раствор дезинфекционного средства на цветной питательной среде в концентрации, несколько превосходящей ту, которая рекомендована для практического использования, если это возможно, или в той концентрации, которая не вызывает существенного изменения цвета среды. Бактериальные культуры, эталонные или испытуемые, вначале испытывают в концентрации 5-107 м. кл. на способность вызывать изменение цвета питательной среды при термостатировании. Если испытуемая культура бактерий вызывает изменение исходной окраски питательной среды в подходящие сроки, то можно ее включать в испытания в сравнении с эталонной культурой того же вида и вынести суждение о возможной устойчивости выделенной на объекте культуры к дезинфекционному средству [10; С. 271].
Испытания ведут в 96-луночковых пластинах с плоским дном. Объем лунок - 0,2 мл. Готовят последовательные разведения дезинфекционного препарата на цветной питательной среде в объеме 0,1 мл. Затем в лунки привносят по 0,05 мл взвеси бактерий на цветной питательной среде - 5-107 м. кл. Пластины держат в термостате 37°С в течение 4 часов. Обычно этого времени достаточно, чтобы контроль культуры уже изменил свой цвет, но иногда требуется 6 часов. Если необходимости в скором учете результатов нет, то пластины переносят в комнатную температуру и учитывают на следующий день как цвет питательной среды, так и мутность (некоторые бактерии, например, бактерии чумы, успевают к этому времени осесть на дно лунок) [1; С. 241].
При использовании упрощенной и ускоренной методики не следует опасаться контаминации питательной среды в луночках посторонними бактериями, способными изменить рН среды, так как незначительное число попавших в луночки посторонних бактерий требует времени для достижения того количества, при котором возможен существенный сдвиг рН. Мы оставляли пластины с питательной средой открытыми в термостате при 37°С и только к концу 24 часа появлялись отдельные луночки. где изменялся цвет, а если такие же пластины оставляли на 4 часа при 37°С, а затем при комнатной температуре, то изменение цвета в отдельных луночках наступало на 3 сутки. Поэтому мы не очень опасались посторонних микроорганизмов и не создавали особых стерильных условий.
Те дезинфекционные препараты, рН которых существенно отклоняется от нейтральной, должны быть оценены специальным образом. Это в большей мере относится к композиционным препаратам, включающим в себя сильно кислые или щелочные компоненты.
Бондарев и др. измеряли антибактериальную активность дезинфекционных средств путем применения бумажных дисков, смоченных дезинфекционным средством по аналогии с методикой, употребляющейся для определения антибактериальной активности антибиотиков.
До сих пор наряду с определением прямого действия дезинфекционного средства на репродуктивную способность бактерий, определяемую по результатам посева на агар или в бульон, необходимо было использовать какой-либо адекватный нейтрализатор активнодействующего вещества, чтобы остановить действие дезинфектанта на бактерии после экспозиции, но перед посевом. Как известно, хлорамин удачно нейтрализуют гипосульфитом натрия, а формалин - аммиаком. Однако в других случаях катионные аммониевые основания принято нейтрализовать анионными соединениями, взятыми в эквимолярной концентрации. Наш опыт свидетельствует о том, что подобная "нейтрализация" порой неэффективна, возможно, из-за того, что взаимодействие агента и нейтрализатора обратимо. В других случаях и вовсе неизвестны эффективные и безвредные для бактерий нейтрализаторы, что затрудняет определение экспозиции, достаточной для разрушения бактерий. Не следует забывать, что в дезинфекционной практике, если и применяется экспозиция, то она достигается не применением нейтрализаторов, а чаще всего отмывкой водой дезинфекционного средства или другими способами. Поэтому применение нашей методики, ставящей своей целью упрощенное и ускоренное определение антибактериальной активности без прямого определения минимальной экспозиции, является вполне достаточным способом установления активности препарата как в сравнении с активностью других препаратов, так и самого по себе по отношению к испытуемым бактериальным культурам [4; С. 4-5].
Нам пришлось исследовать несколько образцов госпитальных культур, которых бактериологи одной из больниц г. Москвы заподозрили в устойчивости по отношению к дезинфекционному препарату "Дезэффект", но с помощью предлагаемой методики подтвердить этого не удалось, так как чувствительность испытуемых культур оказалась примерно равной чувствительности эталонных бактериальных культур [5; С. 135].
1. Применение цветных питательных сред, больших доз бактерий и пластмассовых пластин с лунками являются основой разработанной ускоренной и упрощенной методики определения антибактериальной активности дезинфекционных средств.
2. Учет результатов испытаний активности дезинфекционных средств опирается на регистрацию изменения цвета питательной среды после термостатирования смесей раствора дезинфекционных средств и бактерий, а также на визуальном учете мутности в лунках пластины.
3. Разработанная методика позволяет не тoлькo оценивать антибактериальную активность большинства дезинфекционных средств, но и испытывать предполагаемую резистентность бактериальных культур (в том числе госпитальных) к дезинфекционным средствам.
Заключение
Таким образом, устойчивость бактерий к дезинфектантам - свойство бактерий, проявляющееся в их способности к росту и размножению в присутствии дезинфицирующего средства в определенных концентрациях.
Известно бактерии имеют характерный спектр и уровень естественной устойчивости к конкретной группе химических средств или конкретному дезинфицирующему средству. Наряду с естественной (природной) устойчивостью бактерий, может формироваться приобретенная устойчивость. Приобретенная устойчивость является результатом изменчивости, в результате которой бактерия приобретает новые или утрачивает исходные признаки. У большинства бактерий изменчивость выражена значительнее, чем у высших организмов, что связано с коротким периодом генерации и другими факторами.
Существуют различные методики определения устойчивости бактерий к дезинфектантам.
Это методика Гудковой Е.И. и Красильникова А.П. для определения активности дезинфектантов. Для испытания на устойчивость используют чистые культуры бактерий, выделенные с помощью стандартных методик. Испытание проводят не позже 1-2 дней после выделения. Перед испытанием культуры засевают на скошенный питательный агар, выращивают в термостате при 37° С в течение 16-20 ч, смывают 0,9% раствором хлорида натри с 20% лошадиной сыворотки, стандартизируют плотность" в 2-109 бактерий/мл. Культуры испытывают раздельно; при массовых исследованиях допустимо объединение нескольких культур из одного объекта.
Также существует методика, основанная на применении цветной питательной среды, больших доз бактерий и пластмассовых пластин с луночками является основой ускоренного и упрощенного способа определения антибактериальной активности дезинфекционных средств. Учет результатов испытания активности дезинфекционных средств опирается на регистрацию изменения цвета питательной среды после термостатирования смесей раствора дезинфекционного средства и взвеси бактерий, а также на учете мутности в лунках пластины.
Из всего вышесказанного можно сделать вывод, что разработанные методики позволяют не только оценивать антибактериальную активность большинства дезинфекционных средств, но и определять устойчивость бактериальных культур (в том числе госпитальных) к дезинфекционным средствам.
Библиография
1. Алешукина А.В. Медицинская микробиология: Учеб. пособие для вузов.- Ростов н/Д: Феникс, 2003.
2. Афиногенов Г.Е.; Краснова М.В.; Доморад А.А. Способ оценки эффективности дезинфектантов и антисептиков // http://ru-patent.info/21/90-94/2191829.html3. Бессонова В.Я., Лившиц М.М. Применение цветных питательных среда процессе контроля стерилизации // Клиническая и лабораторная диагностика.- 1993.- № 2.- С. 65.
4. Бондарев В.А., Алтайская Г.Б., Горбунова 3.А. Организация работы Липецкого областного центра дезинфекции и стерилизации по определению активности дезинфектантов к различным микроорганизмам // Дезинфекционное дело.- 1999.- № 2 .- С. 4-5.
5. Быков А.С., Пашков Е.П., Рыбакова А.М. Микробиология: Учебник для вузов.- М.: Медицина, 2003.
6. Воробьев А.А. Медицинская и санитарная микробиология: Учеб. пособие для вузов.- М.: ACADEMIA, 2003.
7. Гудкова Е.И. , Красильников А.П. Методика определения и показатели чувствительности (устойчивости) бактерий к дезинфектантам // Клиническая лабораторная диагностика.- 1994.- № 6.- С. 48-50.
8. Гусев М.В. Микробиология: Учебник для вузов.- 4-е изд., стереотип.- М.: ACADEMIA, 2003.
9. Дезинфектанты // http://www.antibiotic.ru
10. Дикий И.Л. Микробиология. Учебник.- М.: Рыбари, 2004.
11. Красильников А.А., Рябцева Н.Л., Гудкова Е.И. Прошлое, настоящее и будущее четвертичных аммонийных соединений // http://belaseptika.by/press/publication/articles/133/
12. Леви М.И. К методике определения бактерицидной способности дезинфектантов, антисептиков и антибиотиков // Дезинфекционное дело.- 2001.- № 3.- С. 10.
13. Леви М.И., Сучков Ю.Г. Ускоренный и упрощенный способ определения антибактериальной активности дезинфекционных средств // Дезинфекционное дело.- 99.- № 3.- С. 21.
14. Медицинская микробиология, вирусология и иммунология: Учебник для студентов медицинских вузов / Под ред. А.А. Воробьева.- 2-е изд., испр. и доп.- Москва: Медицинское информационное агентство, 2008.
15. Медицинские новости // http://medwikipedia.ru/lenta-mira/48/dezinfektanty-formiruyut-ustoichivost-kantibiotikam
16. Монисов А.А. Методические рекомендации по ускоренному определению устойчивости бактерий к дезинфекционным средствам // http://www.pravoteka.ru/pst/3/1495.html
17. Пантелеева Л.Г. Научно-методические основы разработки и оценки перспективных средств дезинфекции при вирусных инфекциях журнал // Поликлиника.- 2008.- №6.- С. 78.
18. По материалам: Би-би-си. Бактерии могут приобретать устойчивость к действию дезинфектантов и антибиотиков // http://www.eurolab.ua/news/world-news/31686/