 | |
МЕНЮ
- Главная
- Языкознание филология
- Финансовые науки
- Управленческие науки
- Товароведение
- Технология
- Теплотехника
- Теория организации
- Теория государства и права
- Таможенная система
- Схемотехника
- Строительство
- Страхование
- Статистика
- Религия и мифология
- Психология и педагогика
- Промышленность производство
- Медицинские науки
- Медицина
- Краеведение и этнография
- Компьютерные науки
- История
- Искусство и культура
- Информатика
- Инвестиции
- Издательское дело и полиграфия
- Зоология
- Журналистика
- Естествознание
- Деньги и кредит
- Делопроизводство
- Гражданское право и процесс
- Государство и право
- Геополитика
- Геология
- Геодезия
- География
- Военная кафедра
- Ветеринария
- Валютные отношения
- Бухгалтерский учет и аудит
- Ботаника и сельское хоз-во
- Биржевое дело
- Биология и химия
- Биология
- Безопасность жизнедеятельности
- Банковское дело
- Астрономия
- Астрология
- Архитектура
- Арбитражный процесс
- Административное право
- Авиация и космонавтика
- Карта сайта
Курсовая работа: Тесты как инструмент измерения уровня знаний по теме: "Кислородсодержащие органические соединения с элементами экологии"
n(CO2) = V(CO2) / VM = 3,36 л : 22,4 л/моль = 0,15 моль n(H2O) = m(H2O) / M(H2O) = 5,4 г : 18 г/моль = 0,3 моль Следовательно, в состав исходного соединения входило 0,15 моль атомов углерода и 0,6 моль атомов водорода: n(H) = 2n(H2O), так как в одной молекуле воды содержатся два атома водорода. Вычислим их массы по формуле: m = n х M
m(H) = 0,6 моль х 1 г/моль = 0,6 г
m(С) = 0,15 моль х 12 г/моль = 1,8 г
Определим, входил ли кислород в состав исходного вещества:
m(O) = 4,8 - (0,6 + 1,8) = 2,4 г
Найдем число моль атомов кислорода:
n(O) = m(O) / M(O) = 2,4 г : 16 г/моль = 0,15 моль
Соотношение числа атомов в молекуле исходного органического соединения пропорционально их мольным долям:
n(CO2) : n(H) : n(O) = 0,15 : 0,6 : 0,15 = 1 : 4 : 1
самую маленькую из этих величин (0,15) принимаем за 1, а остальные делим на нее.
Итак, простейшая формула исходного вещества CH4O. Однако по условию задачи требуется определить молекулярную формулу, которая в общем виде такова: (CH4O)х. Найдем значение x. Для этого сравним молярные массы исходного вещества и его простейшей формулы:
x = M(CH4O)х / M(CH4O)
Зная относительную плотность исходного вещества по водороду, найдем молярную массу вещества:
M(CH4O)х = M(H2) х D(H2) = 2 г/моль х 16 = 32 г/моль
x = 32 г/моль / 32 г/моль = 1
Есть и второй вариант нахождения x (алгебраический):
12x + 4x + 16x = 32; 32 x = 32; x = 1
Ответ. Формула исходного органического вещества CH4O.
Задача 2. Какой объем водорода (н.у.) получится при взаимодействии 2 моль металлического натрия с 96%-ным (по массе) раствором этанола в воде (V = 100 мл, плотность d = 0,8 г/мл).
Решение. В условии задачи даны количества обоих реагентов - это верный признак того, что какой-нибудь из них находится в избытке. Найдем массу этанола, введенного в реакцию:
m(раствора) = V х d = 100 мл х 0,8 г/мл = 80 г m(C2H5OH) = {m(раствора) х w%} : 100% = 80 г х 0,96 = 76,8 г
(1) 2C2H5OH + 2Na = 2C2H5ONa + H2
на 2 моль этанола -- 2 моль натрия -- 1 моль водорода
Найдем заданное количество этанола в моль:
n(C2H5OH) = m(C2H5OH) / M(C2H5OH) = 76,84 г : 46 г/моль = 1,67 моль
Поскольку заданное количество натрия составляло 2 моль, натрий в нашей задаче присутствует в избытке. Поэтому объем выделенного водорода будет определяться количеством этанола:
n1(H2) = 1/2 n(C2H5OH) = 1/2 х 1,67 моль = 0,835 моль V1(H2) = n1(H2) х VM = 0,835 моль х 22,4 л/моль = 18,7 л
Но это еще не окончательный ответ. Будьте внимательны! Вода, содержащаяся в растворе спирта, тоже реагирует с натрием с выделением водорода.
Найдем массу воды:
m(H2O) = {m(раствора) х w%} : 100% = 80 г х 0,04 = 3,2 г n(H2O) = m(H2O)/M(H2O) = 3,2 г : 18 г/моль = = 0,178 моль
(2) 2H2O + 2Na = 2NaOH + H2
на 2 моль воды -- 2 моль натрия -- 1 моль водорода
Количество натрия, оставшееся неизрасходованным после реакции с этанолом, составит: n(Na, остаток) = 2 моль - 1,67 моль = 0,33 моль Таким образом, и по сравнению с заданным количеством воды (0,178 моль) натрий все равно оказывается в избытке.
Найдем количество и объем водорода, выделившегося по реакции (2): n2(H2) = 1/2 n(H2O) = 1/2 х 0,178 моль = 0,089 моль V2(H2) = n2(H2) х VM = 0,089 моль х 22,4 л/моль = 1,99 л Общий объем водорода:
V(H2) = V1(H2) + V2(H2) = 18,7 л+ 1,99 л = 20,69 л
Ответ: V(H2) = 20,69 л
Задача 3. Вычислите массу уксусной кислоты, которую можно получить из 44,8 л (н.у.) ацетилена, если потери на каждой стадии получения составляют в среднем 20%.
Решение
C2H2 + H2O =>(Hg2+,H2SO4)=> CH3CHO =>([O])=> CH3COOH
1моль ==> 1 моль ==> 1 моль
n(CH3COOH)теор = n(C2H2) = V(C2H2) / VM = 44,8 л : 22,4 л/моль = 2 моль n(CH3COOH)практ = n(CH3COOH)теор х h1 х h2 = 2 моль х 0,8 х 0,8 = 1,28 моль Масса уксусной кислоты с учетом всех потерь составит: m(CH3COOH) = n(CH3COOH)практ х M(CH3COOH) = 1,28 моль х 60 г/моль = 76,8 г
Ответ. m(CH3COOH) = 76,8 г
Задача 4. При окислении смеси бензола и толуола подкисленным раствором перманганата калия при нагревании получено 8,54 г одноосновной органической кислоты. При взаимодействии этой кислоты с избытком водного раствора гидрокарбоната натрия выделился газ, объем которого в 19 раз меньше объема такого же газа, полученного при полном сгорании исходной смеси углеводородов. Определите массы веществ в исходной смеси.
Решение
Перманганатом калия окисляется только толуол, при этом образуется бензойная кислота:
5С6Н5-СН3 + 6KMnO4 + 9H2SO4 → 5С6Н5-СООН + 3K2SO4 + 6MnSO4 + 14Н2О
v(C6H5-COOH) = 8,54/122 = 0,07 моль = v(C6H5-CH3).
При взаимодействии бензойной кислоты с гидрокарбонатом натрия выделяется СО2:
С6Н5-СООН + NaHCO3 → C6H5-COONa + СО2↑ + Н2О.
v(CO2) = v(C6H5-COOH) = 0,07 моль.
При сгорании смеси углеводородов образуется 0,07*19 = 1,33 моль СО2. Из этого количества при сгорании толуола по уравнению
С6Н5-СН3 + 9О2 → 7СО2 + 4Н2О
образуется 0,07*7 = 0,49 моль СО2. Остальные 1,33-0,49 = 0,84 моль СО2 образуются при сгорании бензола:
С6Н6 + 7,5О2 → 6СО2 + ЗН2О.
v(C6H6) = 0,84/6 = 0,14 моль.
Массы веществ в смеси равны:
m(С6Н6) = 0,14-78 = 10,92 г, m(С6Н5-СН3) = 0,07*92 = 6,48 г.
Ответ. 10,92 г бензола, 6,48 г толуола.
Задача 5. Эквимолярная смесь ацетилена и формальдегида полностью прореагировала с 69,6 г оксида серебра (аммиачный раствор). Определите состав смеси (в % по массе).
Решение
Оксид серебра реагирует с обоими веществами в смеси:
НС ≡ СН + Аg2О → AgC ≡ CAg↓ + Н2О,
СН2О + 2Аg2О → 4Аg↓ + СО2 + Н2О.
(Уравнения реакции записаны в упрощенном виде).
Пусть в смеси содержалось по х моль С2Н2 и СН2О. Эта смесь прореагировала с 69,6 г оксида серебра, что составляет 69,6/232 = 0,3 моль. В первую реакцию вступило х моль Аg2О, во вторую — 2х моль Аg2О, всего — 0,3 моль, откуда следует, что х = 0,1.
m(C2H2) = 0,1 - 26 = 2,6 г; m(CH2O) = 0,1-30 = 3,0 г;
общая масса смеси равна 2,6+3,0 = 5,6 г. Массовые доли компонентов в смеси равны:
(С2Н2) = 2,6/5,6 = 0,464, или 46,4%; (СН2О) = 3,0/5,6 = 0,536, или 53,6%.
Ответ. 46,4% ацетилена, 53,4% формальдегида.
Задача 6. Через 10 г смеси бензола, фенола и анилина про пустили ток сухого хлороводорода, при этом выпало 2,59 г осадка. Его отфильтровали, а фильтрат обработали водным раствором гидроксида натрия. Верхний органический слой отделили, его масса уменьшилась на 4,7 г. Определите массы веществ в исходной смеси.
Решение
При пропускании через смесь сухого хлороводорода выпадает осадок хлорида фениламмония, который нерастворим в органических растворителях:
C6H5NH2 + HCl → C6H5NH3Cl ↓.
v ( C 6 H 5 NH 3 Cl ) = 2,59/129,5 = 0,02 моль, следовательно v ( C 6 H 5 NH 2 ) = 0,02 моль, m ( C 6 H 5 NH 2 ) = 0,02.93 = 1,86 г.
Уменьшение массы органического слоя на 4,7 г произошло за счет реакции фенола с гидроксидом натрия:
С6Н5ОН + NaOH → C6H5ONa + Н2О.
Фенол перешел в водный раствор в виде фенолята натрия. m (С6Н5ОН) = 4,7 г. Масса бензола в смеси составляет 10 - 4,7 -1,86 = 3,44 г.
Ответ. 1,86 г анилина, 4,7 г фенола, 3,44 г бензола.
Задача 7. Этиленовый углеводород присоединяет 6,72 л (н.у.) хлороводорода. При гидролизе продукта реакции водным раствором гидроксида натрия при нагревании образуется 22,2 г предельного одноатомного спирта, содержащего три метильные группы. Определите строение исходного углеводорода и полученного спирта.
Решение
Запишем уравнения реакций:
СnН2n + НСl → СnН2n+1Сl,
CnH2n+1Cl + NaOH → CnH2n+1OH + NaCl.
v(HCl) = 6,72/22,4 = 0,3 моль.
Согласно уравнениям реакций,
v(CnH2n+1OH) = v(CnH2n+1Cl) = v(HCl) = 0.3 моль.
Молярная масса спирта равна:
M(CnH2n+1OH) = 22,2/0,3 = 74 г/моль, откуда n = 4.
Следовательно, молекулярная формула спирта — С4Н9ОН.
Из четырех спиртов состава С4Н9ОН только третичный спирт (2-метилпропанол-2, или трет-бутиловый спирт) содержит три метильные группы. В состав молекулы этого спирта входит разветвленный углеродный скелет, следовательно, исходный алкен состава С4Н8 тоже имел разветвленный скелет. Это 2-метилпропен. Уравнения реакций:
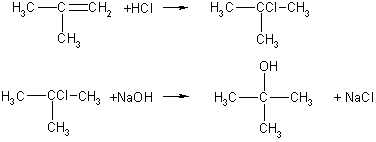
Ответ. 2-метилпропен; трет-бутанол.
Задача 8. Соединение неизвестного строения медленно реагирует с натрием, не окисляется раствором дихромата натрия, с концентрированной соляной кислотой реагирует быстро с образованием алкилхлорида, содержащего 33,3% хлора по массе. Определите строение этого соединения.
Решение
Характер реакций с Na, с Na2Cr2O7 и с HCl свидетельствует о том, что неизвестное вещество — третичный спирт, при реакции с HCl образуется третичный алкилхлорид:
ROH + HCl → RCl + Н2О.
Один моль RCl содержит один моль Cl массой 35,5 г, что составляет 33,3% от общей массы, следовательно молярная масса алкилхлорида равна: M(RCl) = 35,5/0,333 = 106,5 г/моль, а молярная масса углеводородного радикала равна: M(R) = 106,5-35,5 = 71 г/моль. Единственный радикал с такой молярной массой -С5Н11.
Третичные спирты имеют общую формулу:
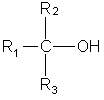
Один атом углерода из пяти соединен с гидроксильной группой, а четыре атома входят в состав трех радикалов. Разбить четыре атома углерода на три радикала можно единственным способом: два радикала СН3 и один радикал С2Н5. Искомый спирт 2-метилбутанол-2:
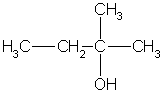
Ответ. 2-метилбутанол-2.
Задача 9. Расположите в порядке возрастания кислотности следующие вещества: фенол, сернистая кислота, метанол. Приведите уравнения химических реакций, подтверждающие правильность выбранной последовательности.
Решение
Правильный ряд выглядит так:
СН3ОН < С6Н5ОН < H2SO3.
Фенол сильнее метанола, поскольку фенол реагирует с растворами щелочей, а метанол — нет:
С6Н5ОН + NaOH = C6H5ONa + H2O , СН3ОН + NaOH —I→
Далее воспользуемся правилом, согласно которому более сильная кислота вытесняет более слабую из ее солей.
C6H5ONa + SO2 + H2O = С6Н5ОН + NaHSO3 .
Фенол вытесняется сернистой кислотой из фенолята натрия, следовательно, сернистая кислота сильнее фенола.
Задача 10. При действии избытка натрия на смесь этилового спирта и фенола выделилось 6,72 л водорода (н.у.). Для полной нейтрализации этой же смеси потребовалось 25 мл 40%-ного раствора гидроксида калия (плотность 1,4 г/мл). Определите массовые доли веществ в исходной смеси.
Решение. С натрием реагируют и этанол, и фенол:
2С2Н5ОН + 2Na → 2C2H5ONa + Н2↑,
2С6Н5ОН + 2Na → 2C6H5ONa + Н2↑,
а с гидроксидом калия -только фенол:
С6Н5ОН + KОН → С6Н5ОK + Н2О.
v(KOH) = 25-1,4-0,4 / 56 = 0,25 моль = v(C6H5OH).
Из 0,25 моль фенола в реакции с натрием выделилось 0,25/2 = 0,125 моль Н2, а всего выделилось 6,72/22,4 = 0,3 моль Н2. Оставшиеся 0,3-0,125 = 0,175 моль Н2 выделились из этанола, которого израсходовано 0,175-2 = 0,35 моль.
Массы веществ в исходной смеси:
m(С6Н5ОН) = 0,25-94 = 23,5 г, m(С2Н5ОН) = 0,35-46 = 16,1 г. Массовые доли: (С6Н5ОН) = 23,5 / (23,5+16,1) = 0,593, или 59,3%, (С2Н5ОН)= 16,1 /(23,5+16,1) = 0,407, или 40,7%.
Ответ. 59,3% фенола, 40,7% этанола.
Задача 11. Среди изомеров состава С7Н7ОK выберите такой, из которого в две стадии можно получить соединение состава С7Н6ОВr2.
Решение. Изомеры состава С7Н7ОK могут быть производными метилфенолов (крезолов) или бензилового спирта — простейшего ароматического спирта:
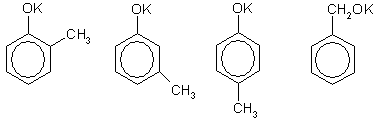
Вещество состава С7Н6ОВr2 - это дибромпроизводное от С7Н8О, которое можно получить по реакции с любой неорганической кислотой (фенол, его гомологи и ароматические спирты — очень слабые кислоты). Два атома водорода можно заместить на два атома брома в бензольном кольце под действием бромной воды, если с бензольным кольцом соединена группа ОН, и при этом одно из орто- и пара-положений по отношению г группе ОН занято группой СН3 (если все эти положения будут свободны от заместителей, то образуется трибромпроизводное). Этому условию удовлетворяют 2-метилфенол (о-крезол) и 4-метилфенол (n-крезол). Таким образом, схема реакций выглядит следующим образом (на примере 2-метилфенолята калия):
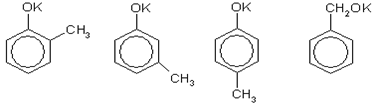
Аналогичная схема справедлива для 4-метилфенолята калия.
Ответ. 2-метилфенолят калия или 4-метилфенолят калия [7, 10, 11, 12].
ТЕСТЫ
1. Различить пробирки с бензольными растворами фенола и этанола можно с помощью:
а) натрия
б) гидроксида калия
в) бромной воды +
г) хлороводорода
2.Какие два органических вещества используются для получения фенола в промышленности?
а) толуол
б) бензол +
в) этилен
г) пропилен +
3.В отличие от этанола фенол реагирует с:
а) калием
б) водным раствором гидроксида калия +
в) хлороводородом
г) гидросульфатом калия
4. При взаимодействии предельных альдегидов с водородом образуются:
а) карбоновые кислоты
б) простые эфиры
в) вторичные спирты
г) первичные спирты +
5. При восстановлении пропаналя образуется:
а) пропановая кислота
б) пропанол-2
в) пропанол-1 +
г) изопропиловый спирт
5. Формалином называется:
а) 35-40%-ный раствор этанола в воде
б) 35-40%-ный раствор метаналя в воде +
в) 35-40%-ный раствор муравьиного альдегида в воде +
г) 35-40%-ный раствор формальдегида в воде +
6. Этаналь можно получить:
а) дегидрированием этанола +
б) окислением этанола кислородом в присутствии катализатора +
в) взаимодействием этилена с водой
г) взаимодействием ацетилена с водой +
7. Гомологами метаналя являются:
а) этаналь +
б) формалин
в) бутаналь +
г) этанол
8.Основной поставщик фенола и формальдегида в атмосферу:
а) медицина
б) деревообрабатывающая промышленность +
в) химическая промышленность +
г) пищевая промышленность
9. ПДК фенола в воздухе:
а) 1 мг/м3
б) 20 мг/м3
в) 17 мг/м3
г) 5 мг/м3 +
10. ПДК фенола в сточных водах:
а) 20 мг/м3
б) 1-2 мг/м3 +
в) 12 мг/м3
г) 4 мг/м3
11. ПДК формальдегида в воздухе:
а) 0,05 мг/м3
б) 0,007 мг/м3
в) 0,003 мг/м3 +
г) 2 мг/м3
12. Смертельная доза 35% водного раствора формальдегида равна:
а) 1 г
б) 100 г
в) 10-50г +
г) 200г
13. Алкоголятами называются продукты взаимодействия:
а) фенолов с активными металлами
б) спиртов с галогеноводородами +
в) спиртов с карбоновыми кислотами
г) спиртов с активными металлами +
14. Укажите названия первичных спиртов:
а) этанол +
б) изопропиловый
в) пропиловый +
г) изобутиловый
15. Укажите названия веществ, с которыми реагирует этанол:
а) бромоводород +
б) уксусная кислота
в) метанол
г) раствор брома в четыреххлористом углероде
16. Назовите по систематической номенклатуре соединение, которое преимущественно получается при взаимодействии водного раствора щелочи с 2- хлорбутаном:
а) 1- бутен
б) 2- бутен
в) 2- бутанол +
г) 1- метил-1- пропанол
17. Какие соединения могут получиться при дегидратации 1- пропанола в различных условиях:
а) пропилен +
б) метилпропиловый эфир
в) дипропиловый эфир +
г) 2- пропанол
18. Этиленгликоль можно получать:
а) взаимодействием ацетилена с водой +
б) взаимодействием этилена с водным раствором перманганата калия +
в) взаимодействием 1,2- дихлорэтана с водным раствором щелочи +
г) взаимодействием этилена с водой
19. С какими веществами реагирует глицерин?
а) нитрат калия
б) азотная кислота +
в) натрий +
г) свежеприготовленный гидроксид меди +
20. При окислении первичного спирта можно получить:
а) алкен
б) альдегид +
в) углекислый газ +
г) простой эфир
21. При дегидратации этилового спирта образуется:
а) этилен
б) ацетилен
в) пропилен +
г) пропин
22. Изомерами бутанола- 1 являются:
а) изопропиловый спирт
б) пропанол- 1
в) бутанол-2 +
г) 2-метилпропанол-2 +
23. Этаналь можно получить:
а) дегидрированием этанола +
б) окислением этанола кислородом в присугствии катализатора +
в) взаимодействием этилена с водой
г) взаимодействием ацетилена с водой +
24. Какой спирт образуется при восстановлении 3-метилбутаналя?
а) третичный бутиловый
б) 2-метилбуганол-1
в) 3-метилбуганол-1 +
г) 2-метилбутанол-4
25. Гомологами метаналя являются:
а) этаналь +
б) формалин
в) бутаналь +
г) этанол
26. Какое вещество является изомером 2-метилпропаналя?
а) 1-буганол
б) буганаль
в) валериановый альдегид +
г) пентаналь +
27. Какие из перечисленных веществ являются между собой гомологами?
а) масляный альдегид +
б) этанол
в) диметиловый эфир
г) пентаналь +
28. Какие соединения могут образоваться при окислении этаналя в различных условиях?
а) этанол
) этановая кислота
в) углекислый газ
г) пропионовая кислота
29. При окислении этилена кислородом в присутствии хлоридов палладия и меди преимущественно образуется:
а) этанол
б) этановая кислота +
в) ацетальдегид
г) этаналь
30. С какими веществами реагирует метановая кислота?
а) метанол +
б) алюминий +
в) карбонат натрия +
г) аммиачный раствор оксида серебра +
31. В отличие от других монокарбоновых кислот предельного ряда муравьиная кислота:
а) реагирует с натрием
б) жидкость при обычных условиях
в) легко окисляется +
г) представляет собой по строению альдегидокислоту +
32. При растворении в воде 1 моль уксусного ангидрида образуете
а) 2 моль этаналя
б) 2 моль этанола
в) 2 моль уксусной кислоты +
г) 1 моль метилацетата
33. С какими веществами реагирует ацетат натрия?
а) соляная кислота +
б) гидроксид натрия при нагревании +
в) угольная кислота
г) этан
34. При взаимодействии этанола и оксида углерода (П) соответствующих условиях получается?
а) этаналь
б) пропаналь
в) пропановая кислота +
г) метилацетат
35. С какими веществами реагирует муравьиная кислота?
а) хлорид меди (П)
б) сульфат натрия
в) гидрокарбонат калия +
г) аммиачный раствор оксида серебра +
36. В отличие от стеариновой кислоты олеиновая кислота:
а) жидкая при комнатной температуре +
б) растворима в воде
в) обесцвечивает бромную воду +
г) реагирует со щелочами
37. Какие вещества реагируют с водородом?
а) линолевая кислота +
б) этанол
в) пропаналь +
г) пропан
38. Какая реакция лежит в основе получения сложных эфиров?
а) нейтрализации
б) полимеризации
в) этерификации +
г) гидрирования
38. Какая кислота получается при окислении изобутилового спирта:
а) бутановая +
б) масляная
в) валериановая
г) 2- метилпропановая
39. Уксусную кислоту нельзя получить:
а) окислением ацетальдегида
б) восстановлением этаналя +
в) окислением бутанола +
г) окислением метана
40. Гомологи уксусной кислоты являются электролитами:
а) слабыми +
б) сильными
в) амфотерными
г) все предыдущие ответы неверны
41. С какими веществами реагирует как фенол, так и бензол?
а) бром +
б) нитрующая смесь
в) натрий +
г) водный раствор гидроксида натрия
42. Для обнаружения фенола используют:
а) хлороводород
б) свежеприготовленный раствор меди (II)
в) хлорид железа трехвалентный +
г) бромная вода +
43. Как называется альдегид
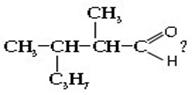 :
:
а) 2-Метил-3-пропилбутаналь; б) 2,3-диметилгексаналь; в) 4,5-диметилгексаналь; + г) 2-метил-2-пропилбутаналь.
44. С каким из веществ будет взаимодействовать этиловый спирт?
а) NaOH; + б) Na; в) СаСО3; + г) НСl.
45. Расположите вещества в порядке увеличения кислотных свойств.
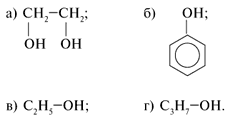
Ответ: в, а, б
46. Расположите вещества в порядке увеличения кислотных свойств.
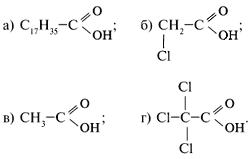
Ответ: а, в, г
47. Какая реакция протекает при термическом крекинге нефтепродуктов
а) гидратации
б) хлорирования
в) разрыва связи С-С +
г) гидрирования [8, 9, 10].
| Количество выполненных заданий, в % | Оценка |
| 35-40 | неудовлетворительно |
| 40-60 | удовлетворительно |
| 60-90 | хорошо |
| 90-100 | отлично |
ЛИТЕРАТУРА
1.Шишов С.Е., Кальней В.А. Школа: мониторинг качества образования. - М., 2000.
2.Горковенко М.Ю. Поурочные разработки по химии, Москва «ВАКО», 2005.
3.Ахметов Н.С. Учебник для 10класса общеобразовательных учреждений. М.: Просвещение, 1998 г.
4.Рудзитис Г.Е., Фельдман Р.Г. Учебник для 10 класса средней школы. М.: Просвещение, 1992.
5. Стадницкий Г.В., Родионов А.И. Экология: Учеб. пособие для вузов — 4-е изд., исправл. — СПб: Химия, 1997. - 240 с.: ил.
6. Мазур И.И., Молдаванов О.И. Курс инженерной экологии: Учеб. для вузов / Под ред. И.И. Мазура.— М.: Высш. шк., 1999.- 447 с.
7. Габриелян О.С., Остроумов И.Г., Остроумова Е.Е. Органическая химия в тестах, задачах, упражнениях. 10 класс: Учеб. пособие для общеобразовательных учреждений. – М.: Дрофа, 2004. – С. 190–215.
8. Энциклопедия для детей. Т. 17. Химия / Под ред. В.А. Володина. – М.: Аванта+, 2001. – С. 370–393
9. Барковский Е.В., Врублевский А.И. Тесты по химии, Минск, Юнипресс, 2002
10. Химия: Большой справочник для школьников и поступающих в вузы / Е.А. Алферова, Н.С. Ахметов, Н.В. Богомолова и др. М.: Дрофа, 1999.
11.Вивюрский В.Я. Вопросы, упражнения и задачи по органической химии с ответами и решениями. - М.: Гуманит. Изд. Центр ВАДОС, 1999. - 688с.
12. Патапов В.М., Татаринчик С.Н., Аверина А.В. Задачи и упражнение по органической химии. - М.: «Химия», 1997. - 144с.