 | |
МЕНЮ
- Главная
- Языкознание филология
- Финансовые науки
- Управленческие науки
- Товароведение
- Технология
- Теплотехника
- Теория организации
- Теория государства и права
- Таможенная система
- Схемотехника
- Строительство
- Страхование
- Статистика
- Религия и мифология
- Психология и педагогика
- Промышленность производство
- Медицинские науки
- Медицина
- Краеведение и этнография
- Компьютерные науки
- История
- Искусство и культура
- Информатика
- Инвестиции
- Издательское дело и полиграфия
- Зоология
- Журналистика
- Естествознание
- Деньги и кредит
- Делопроизводство
- Гражданское право и процесс
- Государство и право
- Геополитика
- Геология
- Геодезия
- География
- Военная кафедра
- Ветеринария
- Валютные отношения
- Бухгалтерский учет и аудит
- Ботаника и сельское хоз-во
- Биржевое дело
- Биология и химия
- Биология
- Безопасность жизнедеятельности
- Банковское дело
- Астрономия
- Астрология
- Архитектура
- Арбитражный процесс
- Административное право
- Авиация и космонавтика
- Карта сайта
Реферат: Технічна термодинаміка та теплові процеси технології будівельних матеріалів
Політропний процес: PVm = const; характеристикою таких процесів є величина
![]() , або
, або ![]() (де
(де ![]() ) (1.19)
) (1.19)
Для процесу розширення:
а) m<1 … (q>0) - підведення тепла, (![]() ) - зростання внутрішньої
енергії; б)
) - зростання внутрішньої
енергії; б) ![]() ; в) m>K … (q<0)
- відведення теплоти, (
; в) m>K … (q<0)
- відведення теплоти, (![]() ).
).
Для процесу стискання:
а) m<1 … теплота відводиться, внутрішня енергія зменшується;
б) K>m>1... теплота відводиться, внутрішня енергія зростає;
в) m>K... теплота підводиться, внутрішня енергія зростає.
Залежність між початковими і кінцевими параметрами:
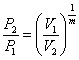 ;
; 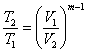 ;
; 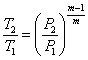 (1.20)
(1.20)
Робота 1 кг газу в політропному процесі визначається за співвідношеннями:
![]() ;
; 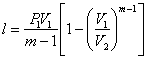 ;
; 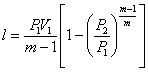 ;
; ![]() (1.21)
(1.21)
Якщо кількість теплоти, яка приймає участь в процесі, відома, то робота обчислюється за формулою:
![]() (1.22)
(1.22)
Теплоємність політропного процесу:
![]() (1.23)
(1.23)
Кількість теплоти, яка сприймається або відбирається від газу:
![]() (1.24)
(1.24)
Зміна внутрішньої енергії газу:
![]() (1.25) Показник політропи
(1.25) Показник політропи ![]() (1.26)
(1.26)
Якщо відомі 2 параметра початкового і кінцевого стану, то
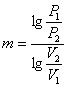 (1.27)
(1.27)
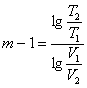 (1.28)
(1.28)
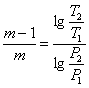 (1.29)
(1.29)
Приклад 1-11. В закритій посудині розміщується газ під розрідженням Р1 = 6667 Па і t1 = 700С. Покажчик барометра - 101325 Па. До якої температури потрібно охолодити газ, щоб розрідження становило Р2 = 13332 Па?
Тут V = const і Р1/Р2 = Т1/Т2, тоді
![]() , звідси Т2 = 318,8К, t2
= 45.80C.
, звідси Т2 = 318,8К, t2
= 45.80C.
Приклад 1-12. В закритій посудині V = 0,6м3 міститься повітря при Р1 = 0,5 МПа і t1 = 200С. Після охолодження посудині повітря втрачає 105 кДж. Визначити, який тиск і температура повітря встановляться у посудині.
Із рівняння стану PV = MRT визначаємо масу повітря в посудині:
![]()
Кількість теплоти ![]() ,
звідси
,
звідси
![]() 0С.
0С.
Тут ![]() (табл.
Д.5; табл. ХІІ (4)).
(табл.
Д.5; табл. ХІІ (4)).
Для ізохорного процесу
![]() .
.
Приклад 1-13. Визначити, яка кількість теплоти, що підведена до газу в ізобарному процесі витрачається на роботу і яка - на зміну внутрішньої енергії.
І закон термодинаміки - ![]() можна представити як
можна представити як
![]() . Величина
. Величина ![]() визначає частку
теплоти, підведеної до газу, яка здійснює роботу розширення. Для ідеального
газу P = const, то
визначає частку
теплоти, підведеної до газу, яка здійснює роботу розширення. Для ідеального
газу P = const, то ![]() і
і ![]() , тоді
, тоді ![]() . Приймаємо К = 1,4, тоді
отримаємо
. Приймаємо К = 1,4, тоді
отримаємо ![]() (тут
(тут ![]() ). Це означає, що в
ізобарному процесі лише 28,5% підведеної теплоти до газу перетворюється в
роботу, а решта 71,5% теплоти збільшує внутрішню енергію системи.
). Це означає, що в
ізобарному процесі лише 28,5% підведеної теплоти до газу перетворюється в
роботу, а решта 71,5% теплоти збільшує внутрішню енергію системи.
Приклад 1-14.1 кг повітря при температурі t1 = 300С і вихідному тиску Р1 = 0,1 МПа стискується ізотермічно до кінцевого тиску Р2 = 1 МПа. Визначити кінцевий об’єм, витрачену роботу і кількість теплоти, яка відводиться від газу.
Із рівняння стану ![]() .
.
При t = const P1V1 = P2V2 і ![]()
Робота стиснення складає:
![]()
Кількість відведеної від газу теплоти дорівнює кількості роботи на стискання газу, q = - 200кДж/кг.
Приклад 1-15. Адіабатне стискання привело до підвищення температури повітря в двигуні і спалаху пального. Об'єм зменшився в 14 разів.
Визначити кінцеву температуру і кінцевий тиск повітря, якщо Р1 = 0,1 МПа, t1 = 1000С.
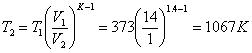 (тут К = 1,4).
(тут К = 1,4).
Кінцевий тиск 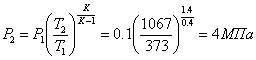 .
.
Приклад 1-16.1 кг повітря при Р1 = 0,5 МПа, t1 = 1110С розширюється політропно до тиску Р2 = 0,1 МПа. Визначити параметри кінцевого стану повітря, зміну внутрішньої енергії, кількість підведеної теплоти і отриману роботу, якщо показник політропи m = 1,2.
Початковий об’єм повітря: ![]()
Кінцевий об’єм повітря: 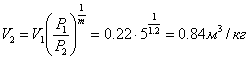
Кінцеву температуру отримаємо із характеристичного рівняння
![]() .
.
Визначаємо роботу:
![]()
Зміна внутрішньої енергії:
![]()
Кількість підведеної теплоти складає:
![]()
Тут зовнішня робота відбувається за рахунок підведення теплоти та зменшення внутрішньої енергії.
![]()
![]() .
.
Приклад 1-17.10 л повітря при тиску Р1=1мПа і температурі t1=250С розширюється в циліндрі із рухомим поршнем до 0,1мПа. Визначити кінцеві об’єм, температуру, роботу, здійснену газом, підведену теплоту, якщо розширення відбувається: а) ізотермічно; б) адіабатно; в) політропно.
а) ізотермічний процес (PV = const)
![]() , t1 = t2 = const. Робота
, t1 = t2 = const. Робота ![]() .
.
Підведено теплоти ![]() .
.
б) Адіабатний процес (PVк = const) ![]() ,
звідси
,
звідси
![]()
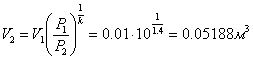
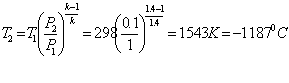 ,
, 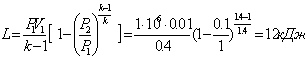 .
.
в) Політропний процес (PVm = const)
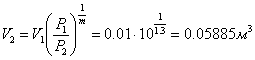 ,
, 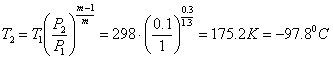 .
.
Робота 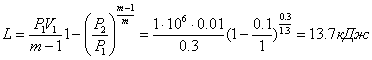 .
.
Підведена теплота: ![]()
Приклад 1-18. Для сушіння керамічних виробів використовують повітря, яке підігрівається в зоні охолодження печі від 17 до 800С. Яка кількість теплоти необхідна на 1 год. сушіння виробів, якщо за цей час витрачається 8 тис. м3 повітря при сталому тиску 750 мм рт. ст. (100 кПа).
![]() .
.
Масу повітря визначаємо із рівняння стану PV = MRT:
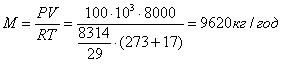 ,
, ![]() ?
?
тут ![]() (МСр
- 29,3 кДж/кмоль для двоатомних газів - довідкова величина).
(МСр
- 29,3 кДж/кмоль для двоатомних газів - довідкова величина).
1.6 Ентропія згідно із ІІ законом термодинаміки для обернених процесів складає
dQ = TdS (1.30)
де dS - нескінченно малий приріст ентропії системи, dQ - нескінчено мала кількість теплоти, Т - абсолютна температура джерела теплоти.
Об'єднавши І і ІІ закони термодинаміки, отримаємо
TdS = dU + pdU
Основним рівнянням для визначення зміни ентропії є вираз
![]() (1.31)
(1.31)
Для газів рахують, що значення ентропії дорівнює нуль при Р=101325 Па і Т = 273,15К. Ентропія для будь-якого стану газів відраховується від нормального стану.
За змінною теплоємністю
![]() (1.32),
(1.32), ![]() (1.33)
(1.33)
![]() (1.34)
(1.34)
За сталою теплоємністю
![]() (1.35)
(1.35)
![]() (1.36)
(1.36)
![]() (1.37)
(1.37)
Зміна ентропії між станом 1 і 2:
![]() (1.38)
(1.38)
![]() (1.39)
(1.39)
![]() (1.40)
(1.40)
При сталій теплоємності
![]() (1.41)
(1.41)
![]() (1.42)
(1.42)
![]() (1.43)
(1.43)
Рівняння ізохори: ![]() (1.44)
(1.44)
Ізобари: ![]() (1.45)
(1.45)
Ізотерми: ![]() (1.46)
(1.46)
Адіабати: S = const, (1.47)
Політропи: ![]() (тут
(тут![]()
![]() (1.48)
(1.48)
Приклад 1-19. Визначити ентропію 1 кг кисню при Р1=0,8мПа і t1=2500С. Теплоємність приймається стала
![]() .
.
Для двоатомних газів МСР = 29,3 кДж/кмоль,
а R = 8,314 кДж/кмоль, то
![]()
Приклад 1-20. Визначити ентропію 1 кг кисню при Р1=0,8мПа і t1=2500С. Теплоємність лінійно залежить від температури.
Тоді ![]() .
.
Для кисню із табл. Д.3 CPm = 0.9127 + 0.00012724t кДж/ (кг∙К)
або Ср = 0,9127 + 0,00025448 (Т-273) кДж/ (кг∙К),
звідси Ср = 0,8432 + 0,00025448Т кДж/ (кг∙К).
Таким чином, а = 0,8432, в = 0,00025448.
Значення ентропії
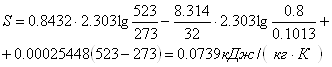
Приклад 1-21.1 кг кисню при t1=1270C розширюється в 5 разів; температура його падає до t2 = 270С. Визначити зміну ентропії за умов сталої теплоємності.
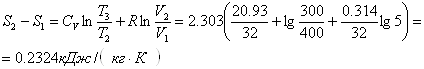
Приклад 1-22.1 кг повітря стискується адіабатно так, що об’єм зменшується в 6 разів, потім при V = const тиск підвищується в 1,5 рази. Визначити загальну зміну ентропії повітря за сталою теплоємністю.
Зміна ентропії повітря в адіабатному процесі дорівнює нулю. Зміна в ізохорному процесі
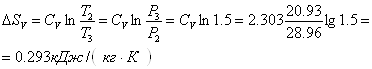
![]()
Приклад 1-23.10 м3 повітря, яке перебувало в нормальних умовах, стискується до набуття температури 4000С:
1) ізобарно;
2) ізохорно;
3) адіабатно;
4) політропно. Визначити ентропію повітря на кінець кожного процесу.
Приймаємо ентропію в нормальних умовах S0 = 0, теплоємність повітря - стала.
Маса повітря в нормальних умовах:
![]()
Зміна ентропії при стисканні:
1) ізобарно ![]()
2) ізохорно ![]()
3) адіабатно ![]()
4) політропно 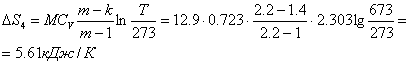
Приклад 1-24. В процесі політропного розширення повітря температура його зменшилася від t1=250C до t2=-370C. Початковий тиск повітря Р1 = 0,4мПа, кількість його М = 2 кг. Визначити зміну ентропії цього процесу, якщо відомо, що кількість підведеної до повітря теплоти складає 89,2 кДж.
Кількість теплоти, яка надається газу в політропному процесі складає:
![]()
Звідси m = 1,2.
Кінцевий тиск: 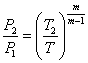 ;
;
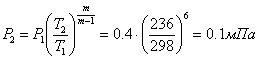
Зміна ентропії: 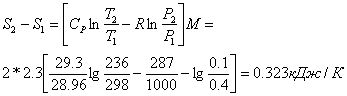
Робота, яку здійснює газ при розширенні є максимальною за умов переходу від початкового стану до стану середовища оберненим шляхом. Максимальна корисна робота менша за максимальну роботу на величину роботи витискання повітря навколишнього середовища.
Максимальну корисну роботу можна визначити за співвідношенням:
![]() (1.49)
(1.49)
(тут параметри 1 і 2 належать до початкового і кінцевого стану джерела роботи, а параметр з індексом 0 належить до робочого середовища).
Виходячи з того, що ![]() та
та ![]() являють собою абсолютну
роботу адіабатного та ізотермічного процесу, формулу (1.49) можна представити
як
являють собою абсолютну
роботу адіабатного та ізотермічного процесу, формулу (1.49) можна представити
як
![]() (1.50)
(1.50)
Приклад 1-25. В посудині об’ємом 300 л перебуває повітря при тиску Р0 = 5 МПа, температурі t1 = 200C. Визначити максимальну корисну роботу, яку може виконати стиснене повітря.
Температура повітря у вихідному стані дорівнює температурі середовища, тому максимальна робота може бути здійснена повітрям лише за умов ізотермічного розширення від Р1 =5МПа до Р2 =0,1 МПа.
![]() , або
, або ![]()
Маса повітря в посудині ![]()
Об’єм повітря після ізотермічного розширення
![]()
Зміна ентропії в ізотермічному процесі
![]() , то
, то 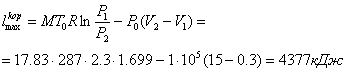
1.7 Круговий процес або цикл
Круговим процесом або циклом називають сукупність термодинамічних процесів, внаслідок яких робоче тіло повертається у вихідний стан. Робота кругового процесу l0 в діаграмі PV визначається площею замкненого контуру циклу. Робота є позитивною, якщо цикл відбувається у напрямку годинникової стрілки (прямий цикл) і від'ємна - якщо проти годинникової стрілки (обернений цикл).
Прямий цикл є характерним для теплових двигунів (l0 >0), обернений - для холодильних машин (l0 <0).
Якщо q1 - кількість тепла, яке передане 1 кг робочого тіла зовнішнім (верхнім) джерелом теплоти, а q2 - кількість тепла, яку віддає робоче тіло зовнішньому охолоджувачу, то корисно використана в циклі теплота q1-q2=l0. В діаграмі T-S ця теплота дорівнює площі контуру цикла, вона адекватна роботі за один цикл і є позитивною, як і в діаграмі P-V, якщо цикл відбувається проти годинникової стрілки.
Термічний К. к. д. дорівнює: ![]() . (1.51)
. (1.51)
Наприклад, цикл Карно складається із двох адіабат і двох ізотерм.
Кількість підведеної теплоти ![]() (1.52)
(1.52)
Кількість відведеної теплоти ![]() (1.53)
(1.53)
Робота цикла Карно q1-q2=l0, термічний к. к. д.
![]() , (1.54)
, (1.54)
де Т1, Т2 - температури, відповідно верхнього та нижнього джерел теплоти, К.
В поршневих компресорах цикл в діаграмі P-V складається із процесів: всмоктування газу, стискання (тиск зростає, об’єм зменшується), нагнітання. Замикає цикл стан V=0; P1).
Приклад 1-26. Компресор всмоктує 100 м3/год повітря під тиском Р1 = 0,1 МПа, температурі t1 = 270C. Кінцевий тиск повітря - 0,8 МПа. Визначити теоретичну потужність двигуна приводу компресора та витрату води охолодження, якщо температура її підвищується на 130С. Розрахувати ізотермічний адіабатний і політропний процеси (m=1.2; CH2O=4.19кДж/кг).
1) Ізотермічне стискання. Роботу компресора визначаємо за рівнянням
![]() (1.55)
(1.55)
L0=2.303∙0.1∙106∙100∙lg8 = 20.8МДж/год.
Теоретична потужність двигуна:
![]() (1.56)
(1.56)
Теплота, яка відводиться з водою охолодження складає:
Q = L0 = 20.8 МДж/год
Витрата води охолодження
![]()
2) Адіабатне стискання. З рівняння
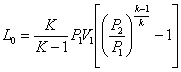 (1.57)
(1.57)
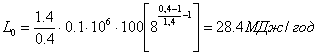
Потужність двигуна
![]()
3). Політропне стискання. З рівняння
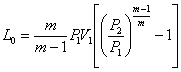 (1.58)
(1.58)
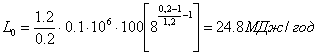
Потужність двигуна
![]()
Кількість теплоти, яка відводиться від повітря, знайдемо за рівнянням:
![]() (1.59)
(1.59)
![]() ;
;
![]() ;
;
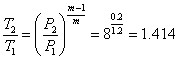 ;
;
![]()
![]() .
.
Витрати води охолодження
![]() .
.
При адіабатному стисканні теоретична робота компресора в К разів більша ніж робота адіабатного стискання; при політропному стисканні робота компресора в m разів більша, ніж робота політропного стикання.
2. Теплопередача
Основні теоретичні положення. Приклади розв’язання задач з теплообміну та задачі для самостійного розв’язання.
2.1 Теплопровідність у стаціонарному режимі при сталій температурі
Теплопровідність у стаціонарному режимі при
сталій температурі всіх точок тіла протягом будь-якого часу (наприклад,
передача тепла крізь стінки печей, сушарок) за рівнянням Фур’є викликає
тепловий потік крізь плоску одношарову стінку (площею 1м![]() ):
):
![]() , Вт, (2.1)
, Вт, (2.1)
де λ - теплопровідність; Вт/ (мк); t1 і t2 - температура з обох боків стінки, град; δ - товщина стінки, м.
Якщо температура гріючого середовища tp![]() , а температура середовища, яке оточує стінку, tp
, а температура середовища, яке оточує стінку, tp![]() (tp
(tp![]() > tp
> tp![]() ), то опір теплопередачі R
та коефіцієнт загальної теплопередачі К пов’язані залежністю:
), то опір теплопередачі R
та коефіцієнт загальної теплопередачі К пов’язані залежністю:
![]() К=
К=![]() +
+![]() +
+![]() , Вт/ (м2К),
, Вт/ (м2К),
Страницы: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10
ИНТЕРЕСНОЕ
© 2009 Все права защищены. |