 | |
МЕНЮ
- Главная
- Языкознание филология
- Финансовые науки
- Управленческие науки
- Товароведение
- Технология
- Теплотехника
- Теория организации
- Теория государства и права
- Таможенная система
- Схемотехника
- Строительство
- Страхование
- Статистика
- Религия и мифология
- Психология и педагогика
- Промышленность производство
- Медицинские науки
- Медицина
- Краеведение и этнография
- Компьютерные науки
- История
- Искусство и культура
- Информатика
- Инвестиции
- Издательское дело и полиграфия
- Зоология
- Журналистика
- Естествознание
- Деньги и кредит
- Делопроизводство
- Гражданское право и процесс
- Государство и право
- Геополитика
- Геология
- Геодезия
- География
- Военная кафедра
- Ветеринария
- Валютные отношения
- Бухгалтерский учет и аудит
- Ботаника и сельское хоз-во
- Биржевое дело
- Биология и химия
- Биология
- Безопасность жизнедеятельности
- Банковское дело
- Астрономия
- Астрология
- Архитектура
- Арбитражный процесс
- Административное право
- Авиация и космонавтика
- Карта сайта
Курсовая работа: Синтез и анализ ХТС в производстве азотной кислоты
В настоящее время неплатиновый катализатор нашёл применение в качестве второй ступени в системе производства азотной кислоты под повышенным давлением.
Применение давления для реакции окисления аммиака до оксида NО позволяет увеличить производительность агрегата, но одновременно с этим ухудшает процесс окисления аммиака. Так, при атмосферном давлении и температуре 1093 К выход оксида NO достигает 97-98%, число платиноидных сеток 4; при увеличении давления до 4·103 Па температура катализа повышается до 1153-1173 К, выход оксида NO снижается до 95-96%, число сеток 12; при давлении 8·105 – 9·105 Па температура процесса 1173-1223 К, выход оксида NO снижается до 94-95%, число сеток в контактном аппарате увеличивают до 16-20.
Однако анализ работающих азотнокислотных систем с агрегатами средней производительности 350-500 т HNO3 в сутки показал, что процесс получения азотной кислоты целесообразно проводить при повышенном давлении как в отделении аммиака, так и в абсорбционном отделении. Особенно эффективно применение повышенного давления в агрегатах повышенной мощности - 1000 т и более моногидрата азотной кислоты в сутки. При создании таких агрегатов капиталовложения сокращаются, и снижается себестоимость продукции.
Для существенного повышения производительности агрегата неконцентрированной азотной кислоты давление в отделении окисления аммиака повышают до 4,5·103 – 8·105 Па, а в абсорбционном отделении - до 12·105 – 16·105 Па. Это даёт возможность получать продукцию повышенной концентрации, увеличить степень использования оксидов азота, уменьшить выброс оксидов азота в атмосферу и увеличить процент рекуперации энергии, затрачиваемой на сжатие газов. Для снижения потерь платины при применении повышенных давлений пока существуют два пути: замена платиноидных катализаторов на сплавы менее дефицитные и дорогие, надежное улавливание платины и возвращение её в производство платиновых катализаторов.
В настоящее время разработаны и опробованы массы на основе окиси кальция, улавливающие до 70-80% платины от общей её потери. Регенерация уловленной платины из масс на основе оксида кальция проще, чем из других масс. Для эффективного улавливания теряемой платины необходима тщательная очистка аммиачно-воздушной смеси от механических примесей, особенно от оксидов железа и пыли железного катализатора синтеза аммиака. Пыль и оксиды железа, попадая на катализаторные сетки, засоряют их, сокращая поверхность соприкосновения смеси газов с поверхностью катализатора и снижая тем самым степень окисления аммиака. Кроме того, эта пыль проникает до поверхности улавливающих масс, блокирует её и снижает степень очистки газа от теряемой платины
1.2. Технологическая часть
1.2.1. Характеристика исходного сырья, вспомогательных материалов и готовой продукции
Характеристика исходного сырья
Аммиак является важнейшим химическим продуктом, так как он служит исходным сырьём для получения самых разнообразных азотсодержащих соединений. Источников связанного азота, имеющих промышленное значение, в природе очень мало.
Азот играет особо важную роль в природе; он участвует в основных биохимических процессах и образует важнейшие питательные вещества для растений, животных и человека.
Достаточно крупные месторождения связанного азота в виде азотнокислого натрия (нитрата натрия) имеются только в Чили, они были открыты в начале 19 в. Небольшое количество связанного азота при переработке коксового газа. Основную же массу азотсодержащих продуктов (около 95%) производят на основе аммиака, искусственно получаемого на химических предприятиях.
Аммиак представляет собой бесцветный газ с характерным запахом. При охлаждении до - 30°С он сжижается, а при 78°С затвердевает, образуя бесцветную кристаллическую массу. Критическая температура аммиака 132,4°С, критическое давление 111,5 атм. Аммиак хорошо растворим в воде: при 20°С и атмосферном давлении в 1л воды растворяется 700 л газообразного аммиака. Несколько хуже он растворяется в органических жидкостях.
При непосредственном соединений аммиака с кислотами получают соли, например нитрат или сульфат аммония. При взаимодействии аммиака с СО2 образуется карбамид (мочевина), который является одним из лучших азотных удобрений благодаря высокой концентрации азота и хорошим физическим свойствам; на основе карбамида получают также разнообразные химические продукты.
Водные растворы аммиака (аммиачная вода), водно-аммиачные растворы солей и жидкий аммиак широко применяются в сельском хозяйстве для непосредственного внесения в почву в качестве жидких азотных удобрений.
Сухие аммиак и воздух образуют взрывоопасные смеси; пределы взрываемости таких смесей при 18°С ограничены интервалом содержания аммиака от 15,5 до 27%. Таким образом, смеси, содержащие менее 15,5 и более 27% аммиака, при зажигании их искрой не взрываются. При повышении температуры пределы взрываемости аммиачно-воздушных смесей расширяются. Учитывая эти особенности аммиачно-воздушных смесей, при осуществлении промышленных процессов поддерживают содержание аммиака до 15,5 или выше 27%.
Синтетический аммиак в большей или меньшей степени загрязнён примесями. Такими примесями являются катализаторная пыль. Смазочное масло. Для получения газообразного аммиака служат испарительные станции и дистилляционные отделения жидкого аммиака. Дальнейшая очистка осуществляется в фильтрах, состоящих из чечевицеобразных элементов, фильтрующим материалом в которых служит хлопчатобумажная замша. Тонкой очистке аммиачно-воздушная смесь подвергается в фильтре с поролитовыми трубками.
Характеристика готового продукта
Химически чистая азотная кислота (мол. масса 63) представляет собой бесцветную жидкость с сильным едким запахом. На воздухе концентрированная азотная кислота дымит, смешивается с водой в любых соотношениях с выделением тепла. Чистая безводная азотная кислота малоустойчива. Теплоёмкость водных растворов азотной кислоты уменьшается с повышением концентрации азотной кислоты. С увеличением концентрации кислоты температура кипения раствора NH3 - H2O растёт, достигая максимума при 68,4% HNO3, а затем начинает снижаться. Смесь, содержащая 68,4% HNO3, является азеотропной - в её парах столько же азотной кислоты, сколько в жидкости. С ростом давления температура кипения кислоты повышается при сохранении концентрации, отвечающей азеотропной смеси.
Разложение азотной кислоты происходит по уравнению:
2HNO3 = 2NO2 + Н2О + 0,5О2
При нагревании азотная кислота разлагается с выделением N2O3 по уравнению:
2HNO3 = N2O3 + О2 + Н2О
Полностью азотная кислота разлагается при температуре около 533К. Скорость разложения HNО3 возрастает с увеличением её концентрации, а при повышении температуры всего на 5°С. 99%-ная азотная кислота разлагается в два с лишним раза.
Плотность HNO3 изменяется пропорционально её концентрации, что позволяет по величине плотности определять её концентрацию.
Азотная кислота - сильный окислитель. Органические вещества под действием концентрированной азотной кислоты разрушаются, а некоторые из них способны воспламеняться. Азотная кислота растворяет все металлы, кроме золота, платины, титана, тантала, родия и иридия.
Техническая азотная кислота вследствие содержания в ней растворенных NO2 имеет желтоватый цвет. Азотная кислота концентрацией до 60% электропроводна.
Надазотную кислоту получают при обработке концентрированной азотной кислоты 100%-ной перекисью водорода при низкой температуре по реакции:
HNO3 + Н2О2 = HNO4 + Н2О
Надазотная кислота разлагается со взрывом.
Нитроолеум - дымящая жидкость желтоватого цвета, сильный окислитель. Нитроолеум с содержанием 30 об.% NO2 при атмосферном давлении кипит при температуре 311 К, с содержанием 40 об.% NO2 - при температуре 302К. При этом в парах содержится 96,5 об.% оксидов азота и 3,5 об.% паров азотной кислоты.
1.2.2. Модели рассматриваемой ХТС
Химическая модель
4NH3 + 50 2 = 4NO + 6Н2О
2NO+O2=2NO2
3NO2 + H2O = 2NО3 + N0
NH3 + 2О2 = HNO3 + Н2О + 421,2
Технологическая схема
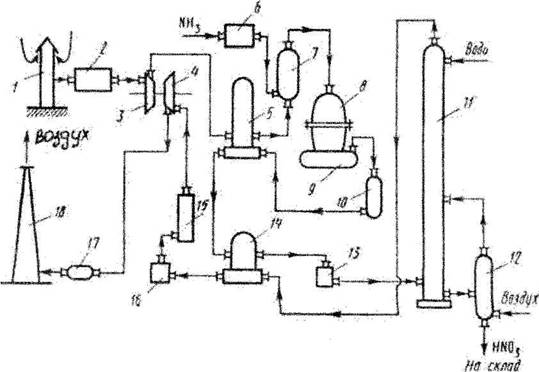
Рис. 3. Технологическая схема производства азотной кислоты
1-воздухозаборная труба; 2-воздухоочиститель; 3-газовый компрессор; 4-газовая турбина; 5-воздухоподогреватель; 6-испаритель аммиака; 7-смеситель с фильтром;
8-контактный аппарат; 9,17-котёл-утилизатор; 10-окислитель с фильтром;
11-абсорбционная колонна; 12-отдувочная колонна; 13-холодильник-конденсатор;
14-подогреватель хвостовых газов; 15-реактор каталитической очистки; 16-камера сгорания; 18-выхлопная труба.
Атмосферный воздух, забранный на территории завода, проходит тщательную очистку от возможных примесей, находящихся в воздухе, проходит воздухозаборную трубу 1 и воздухоочиститель 2. Очищенный атмосферный воздух поступает на всас компрессора газотурбинного агрегата. Сжатие происходит в осевом компрессоре 3, приводимый в движение газовой турбиной 4, до давления 0,73 МПа, нагреваясь при этом до 135°С , и поступает далее в подогреватель воздуха 5, где его температура поднимается до 250оС за счёт теплоты выходящих из окислителя 10 нитрозных газов. В смесителе 7 воздух смешивается с газообразным аммиаком, который поступает сюда из испарителя аммиака 6. Образовавшаяся аммиачно-воздушная смесь далее поступает в контактный аппарат 8, где при температуре около 900°С на Pt. - Rh - Pd -катализаторе происходит окисление аммиака. Нитрозные газы, содержащие 9 -9,5% N0, поступают в котёл-утилизатор 9, в котором происходит охлаждение до необходимой температуры и образование пара. Далее газы поступают в окислитель 10, в котором окисляются до диоксида азота. Охлаждённые в подогревателе воздуха 5, подогревателе хвостовых газов 14 и холодильнике-конденсаторе 13 до температуры около 45°С нитрозные газы поступают в абсорбционную колонну 11, орошаемую противоточно водой. Поскольку абсорбция NO2 водой экзотермична, абсорбционные тарелки снабжены змеевиковыми холодильниками, в которых циркулирует охлаждающая вода. Полученная азотная кислота самотёком поступает в отдувочную колонну 12, где с помощью горячего воздуха из готовой азотной кислоты происходит отдувка растворённых в ней нитрозных газов, которые подаются в абсорбционную колонну. Хвостовые газы, пройдя систему каталитической очистки от оксидов азота восстановлением их аммиаком до элементного азота в атмосферу.
Структурная схема
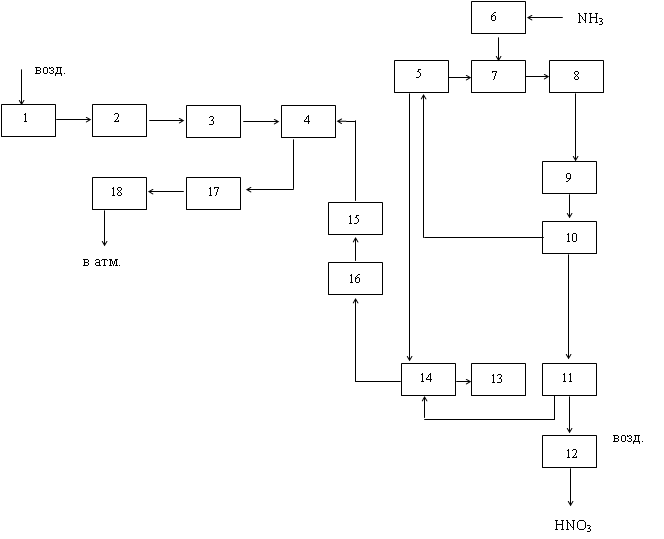
 Функциональная
схема
Функциональная
схема
Операторная схема
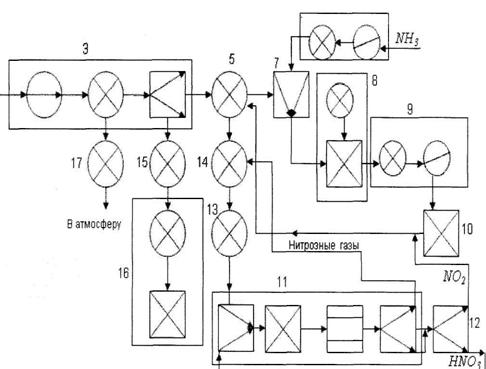
2. Анализ ХТС
Материальный баланс
NH3 + 2O2 ® HNO3 + H2O
М(NH3) = 17 М (HNO3) = 63
М (2O2) = 64 М (H2O) = 18
1. Теоретически необходимое количество NH3:
![]()
С учетом степени окисления:
![]() 0,2698 – 90%
0,2698 – 90%
![]() х - 100%
х - 100%
![]()
Непрореагировавший аммиак: 0,2997 – 0,2698 = 0,0299 т.
2. Теоретически необходимое количество О2:
![]()
С избытком 2О2: 1,016·1,15 = 1,1684 т
(1,15 = 100% + 15%, 1,15 = 1 + 015)
3. Теоретически полученное количество Н2О:
![]()
Таблица материального баланса
| Расход | Масса, т | Приход | Масса, т |
|
NH3 |
0,2997 |
HNO3 |
1,00 |
|
2O2 |
1,1684 |
Н2О |
0,2857 |
|
2O2 избыток |
0,1524 | ||
|
NH3 непрореагир. |
0,0299 | ||
| 1,4681 | 1,468 |
ЗАКЛЮЧЕНИЕ
Неуклонный рост производства азотной кислоты тесно связан с увеличением объёма отходящих газов, а следовательно, с увеличением количества выбрасываемых в атмосферу оксидов азота. Оксиды азота очень опасны для любых живых организмов. Некоторые растения повреждаются уже через 1час пребывания в атмосфере, содержащей 1мг оксидов в 1м3 воздуха. Оксиды азота вызывают раздражение слизистой оболочки дыхательных путей, ухудшение снабжения тканей кислородом и другие нежелательные последствия.
Хвостовые газы производства азотной кислоты содержат после абсобционных колонн от 0,05 до 0,2% оксидов азота, которые по санитарным требованиям без дополнительной очистки запрещено выбрасывать в атмосферу.
Радикальное решение проблемы очистки хвостовых газов - каталитическое восстановление оксидов азота горючими газами - водородом, природным газом, оксидом углерода, аммиаком. Условия проведения процесса и тип используемого катализатора определяется видом применяемого газа. Восстановление оксидов азота снижает их содержание в очищенном газе до 0,001-0,005%, что обеспечивает санитарные нормы по содержанию оксидов азота в приземном слое воздуха при мощностях производства кислоты до 1млн.т в год, сосредоточенных в одной точке и при высоте выброса 100-150м.
Одним из наиболее реальных способов утилизации оксидов азота, обеспечивающих санитарные нормы содержания оксидов азота в приземном слое атмосферы после рассеивания их из выхлопной трубы, является адсорбционно - десорбционный метод, в котором используется непрерывно циркулирующий сорбент (силикагель). Разработаны способы адсорбции на молекулярных ситах, промывки кислым раствором мочевины и другими промывными жидкостями.
На современных установках получения азотной кислоты нет постоянных источников сточных вод. Эти установки потребляют большое количество обратной охлаждающей воды. Растворы, периодически сливаемые из насосов и другого оборудования, например при проведении ремонта, собирают в прямоток и нейтрализуют.
Перспективы развития азотнокислотного производств
Исключительное значение азотной кислоты для многих отраслей народного хозяйства и оборонной техники и большие объёмы производства обусловили интенсивную разработку эффективных и экономически выгодных направлений совершенствования азотнокислотного производства. К таким направлениям относятся:
- создание систем высокой единичной мощности (до 400 тыс.т в год), работающих при повышенном давлении;
- разработка высокоактивных избирательно действующих неплатиновых катализаторов окисления аммиака;
- возможно более полное использование энергии сжатых отходящих газов и низкопотенциальной теплоты процесса путём создания полностью автономных энерготехнологических схем;
- создание замкнутого оборота охлаждающей воды;
- решение проблемы очистки отходящих газов с утилизацией адсорбционного - десорбционного метода очистки на силикагеле и цеолитах;
- возможно более полное удаление остатков азота из отходящих газов с использованием в качестве восстановителей горючих газов и аммиака.
В ходе данной курсовой работы были построены модели ХТС: операторная, структурная, функциональная, математическая. Приведены характеристики вспомогательных материалов и исходных продуктов.
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
1. Салтанова, В.П. Технология связанного азота: учебник / В.П. Салтанова, Н.С. Торочешников. - М.: Высшая школа, 1981. - 205с.
2. Технология связанного азота: учебник / Ф.А. Андреев, СИ. Каргин, Л.И. Козлов, В.Ф. Приставко. - М.: Химия, 1966. - 500с.
3. Общая химическая технология / Под ред. А.Г. Амелина. - М.: Химия, 1977. - 400с.
4. Курс технологии связанного азота / под ред. В.И. Атрощенко. - М: Химия, 1968.-384с.
5. Основы химической технологии / под ред. И.П. Мухлёнова. — 4-е изд., перераб. и доп. - М: Высшая школа, 1991. - 463с. ISBN 5-06-001735-4.
6. Кутепов, A.M. Общая химическая технология: учебник / A.M. Кутепов, Т.И. Бондарева, М.Г. Беренгартен. - 2-е изд., испр. и доп. - М.: Высшая школа, 1990. - 520с. ISBN 5-06-000493-7.
7. Соколов, Р.С. Химическая технология: учебное пособие / Р.С. Соколов. -Т.1. -М: ВЛАДОС, 2000. - 368с. ISBN 5-691-00356-9.