 | |
МЕНЮ
- Главная
- Языкознание филология
- Финансовые науки
- Управленческие науки
- Товароведение
- Технология
- Теплотехника
- Теория организации
- Теория государства и права
- Таможенная система
- Схемотехника
- Строительство
- Страхование
- Статистика
- Религия и мифология
- Психология и педагогика
- Промышленность производство
- Медицинские науки
- Медицина
- Краеведение и этнография
- Компьютерные науки
- История
- Искусство и культура
- Информатика
- Инвестиции
- Издательское дело и полиграфия
- Зоология
- Журналистика
- Естествознание
- Деньги и кредит
- Делопроизводство
- Гражданское право и процесс
- Государство и право
- Геополитика
- Геология
- Геодезия
- География
- Военная кафедра
- Ветеринария
- Валютные отношения
- Бухгалтерский учет и аудит
- Ботаника и сельское хоз-во
- Биржевое дело
- Биология и химия
- Биология
- Безопасность жизнедеятельности
- Банковское дело
- Астрономия
- Астрология
- Архитектура
- Арбитражный процесс
- Административное право
- Авиация и космонавтика
- Карта сайта
Курсовая работа: Методические разработки урока по теме "Спирты"
Параметры процесса брожения выбирают, исходя из оптимальных условий развития дрожжевых клеток и подавления развития их спутников — кислотообразующих бактерий молочнокислого и уксуснокислого брожения.
Так как оптимальные температуры размножения дрожжевых клеток практически совпадают и равны 35— 50 °С, то подавить развитие бактерий изменением температуры нельзя. Для этого повышают кислотность среды, вводя в гидролизат серную или молочную кислоту. При рН 4,2 дрожжевые клетки интенсивно растут, а бактерии не размножаются. Поэтому на практике процесс брожения проводят при температуре 27 С, атмосферном давлении и в кислой среде (рН= =3,8—4,0).
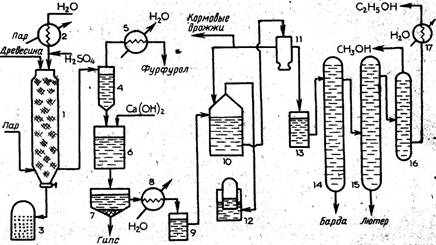
Технологическая схема производства этанола гидролизом древесины. Процесс производства этанола складывается из двух последовательных стадий; объединенных в единую технологическую схему: гидролиза древесины и сбраживания образующегося гидролизата. В нашей стране распространен метод гидролиза древесины разбавленной серной кислотой. В качестве сырья используют отходы хвойной древесины с высоким содержанием гексозанов.
Производство этанола по этой схеме представляет собой полунепрерывный перколяциоиный процесс, в основе которого лежит принцип: непрерывной фильтрации раствора кислоты через периодически загружаемое в реактор древесное сырье с непрерывным в течение нескольких часов отбором гидролизата.. При этом раствор кислоты служит одновременно экстрагентом образующихся при гидролизе моносахаридов. Схема производства этанола гидролизом древесины приведена на рис. 2.
Древесное сырье в виде опилок или измельченной щепы загружают в гидролиз-аппарат 1 — цилиндрический стальной сосуд, футерованный внутри кислотоупорным материалом. После загрузки сырья в аппарат через специальное оросительное устройство подают нагретый до 1$0—190 °С раствор серной кислоты концентрацией около 0,5 %. Воду для получения раствора кислоты подогревают в подогревателе 2. В гидролиз-аппарат вводят также пар и создают давление 1,0—1,2 МПа. Через фильтрующее устройство, расположенное в нижней части гидролиз-аппарата и выполненное в виде перфорированных медных трубок, из аппарата непрерывно отводят гидролизат и направляют его в испаритель 4. Вследствие снижения давления гидролизат вскипает и пары, содержащие фурфурол (tKHn= 161,7 °С при атмосферном давлении), поступают в конденсатор 5. Цикл непрерывной работы гидролиз-аппарата от загрузки до выгрузки составляет несколько часов, затем оставшийся в нем лигнин передавливают после открытия заслонки в сборник после этого в аппарат загружают новую порцию древесного сырья.
После отделения фурфурола гидролизат из испарителя поступает в нейтрализатор 6, куда подают раствор гидроксида кальция, а оттуда —
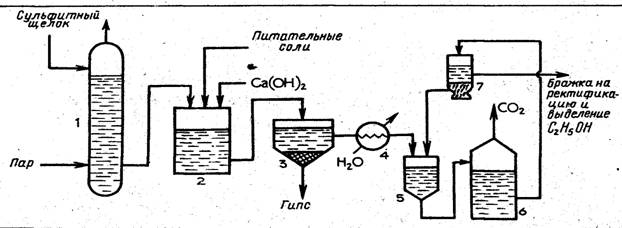
Сульфитный щелок подают в колонну /, где из него паром выдувают примеси. Очищенный щелок поступает в нейтрализатор 2, куда подают раствор гидроксида кальция и вводят питательные соли. Из нейтрализатора щелок после охлаждения до 30 °С в холодильнике 4 направляют сначала на первую ступень брожения в дрожжанку 5, а затем на вторую ступень брожения в бродильный чан 6 и в. сепаратор 7. В сепараторе дрожжи отделяются от образовавшейся бражки, и их возвращают в дрожжанку. После сепаратора бражку, содержащую 1,0— 1,2 % спирта, направляют на концентрирование и выделение этанола аналогично тому, как это происходит в производстве гидролизного этанола (см. рис. 2).
Переработкой сульфитных щелоков можно получить (в расчете на 1 т воздушно-сухой древесины) 90—110 л этанола, 40—50 кг белковых дрожжей, 600—700 кг сухих лигносульфонатов.
Комплексная переработка сульфитных щелоков имеет и большое значение в экологическом плане. Существующие промышленные способы производства целлюлозы не обеспечивают полной утилизации и переработки его отходов — варочных сульфитных щелоков и отдувочных газов. Вследствие этого целлюлозно-бумажная промышленность в настоящее время — одна из основных источников загрязнения водоемов сточными водами.
этанол урок одноатомный спирт
Глава 3. МЕТОДИЧЕСКИЕ РАЗРАБОТКИ ПО ТЕМЕ «СПИРТЫ»
Система уроков по теме: "Предельные одноатомные спирты"
Пояснительная записка.
Все классы органических соединений преподаю блоками. Блок состоит из трех частей:
1. урок-лекция,
2. тренировочные домашние упражнения,
3. урок-коррекция.
Урок-лекция (объяснение нового материала).
Цели:
- ввести понятие предельных одноатомных спиртов, свойств;
- развитие интереса, умения выделять главное, научить сравнивать и анализировать.
1. Определение.
Органические соединения, которые состоят из предельного углеводородного радикала и содержат одну функциональную гидроксильную группу (-ОН), называются насыщенными одноатомными спиртами.
Общая
формула СnН2n+1ОН ( где n![]() 1) или R – ОН
1) или R – ОН
2. Гомологический ряд и номенклатура
СН3 ОН – метиловый спирт (метанол),
СН3 СН2ОН – этиловый спирт (этанол)….
- СН2 - гомологическая разница
Пример: 3-метилгексанол – 1
2. Изомерия положения функциональной группы (-ОН)
Пример: бутанол-1 -> бутанол-2
3. Изомерия между классами (предельные одноатомные спирты изомерны простым эфирам)
4. Физические свойства
1) Спирты от С1 до С11 – жидкости, от С12 до С - твердые.
2) Легче воды, бесцветны, жидкие имеют резкий запах, твердые запаха не имеют.
3) Низшие спирты (до пропилового) смешиваются с водой в любых отношениях. Высшие спирты практически нерастворимы в воде.
Межмолекулярная водородная связь возможна между отдельными молекулами спирта и между молекулами спирта и воды. Это влияет на физические свойства спиртов: повышает температуру кипения, снижает летучесть, способствует хорошей растворимости в воде, не позволяет перегонкой получить 100% спирт из его водного раствора.
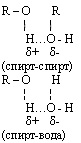
5. Химические свойства (с примерами):
1) горение,
2) взаимодействие с активными металлами;
3) взаимодействие с органическими кислотами, с неорганическими кислотами;
4) с галогеноводородами;
5) окисление
- первичный спирт -> альдегид,
- вторичный спирт -> кетон,
- третичный спирт: тяжело окисляется с разрывом С-С связи;
6) дегидратация:
- внутримолекулярная,
- межмолекулярная с образованием простых эфиров;
7) дегидратация и дегидрирование (реакция Лебедева).
6. Получение одноатомных спиртов (с примерами).
В промышленности:
1) получение СН3 ОН
- из синтез-газа
- во время сухой перегонки древесины (древесный спирт),
2) гидратация алкенов,
3) брожение сахаристых веществ.
В лаборатории:
1) из алканов через галогенопроизводные,
2) восстановление альдегидов.
Физиологическое действие спиртов на организм негативно.
СН3 ОН – сильный яд! В малых количествах вызывает слепоту, в больших – приводит к смерти.
С2Н5ОН – наркотик. Под влиянием этанола у человека ослабляется внимание, затормаживается реакция, нарушается корреляция движений. При продолжительном употреблении вызывает глубокие нарушения нервной системы, заболевания сердечно-сосудистой системы, пищеварительного тракта, наступает тяжелая болезнь – алкоголизм.
7. Применение спиртов.
1) Метанол:
- в промышленном органическом синтезе (производство формальдегида),
- как растворитель,
- как добавка к бензину.
2) Этанол:
- производство уксусной кислоты,
- как растворитель,
- в парфюмерии,
- в медицине,
- как топливо,
- в пищевой промышленности.
8. Связь между ациклическими углеводородами и спиртами (показать на примерах).
Домашнее задание: пар. 17 (учебник О.С. Габриелян), тренировочные упражнения.
Приложение 1. Закрепление (если позволяет время)
1. Назвать по международной номенклатуре (2-4 примера).
2. Написать структурные формулы изомерных спиртов С4Н9 ОН и назвать их.
Приложение 2. Тренировочные домашние упражнения.
Тема: “Одноатомные спирты”.
Сложность 1 (оценка “удовлетворительно”).
1. Написать структурные формулы следующих соединений: 2-метилпентанол-1; 2,3-диметилбутанол-2; 2-метилпентен-1-ол-3.
2. Назвать вещество и написать два его гомолога и два изомера
1. Какой объем водорода выделится при взаимодействии 19,5 г калия с этанолом.
Сложность 2 (оценка “хорошо”).
1. Чем объясняется изомерия спиртов? Пояснить это на примере спирта, в молекуле которого четыре атома углерода. Назвать каждый изомер.
2. Написать реакции получения метанола.
3. Осуществить превращения:
Этан -> бромэтан-> этен-> этанол-> метилэтиловый эфир. Где происходит дегиратация?
4. При сжигании 4,8 г органического вещества образовалось 3,36 л оксида углерода (IV) и 5,4 г воды. Плотность паров этого вещества по метану 2. Определить формулу вещества.
Сложность 3 (оценка “отлично”).
1. Чем отличаются первичные, вторичные и третичные спирты? (Привести примеры каждого и назвать их)
2. Предложить схему получения из пропана пропанол-1.
3. Осуществить превращения (предложить две цепочки).
4. При межмолекулярной дегидратации 100г одноатомного предельного спирта неизвестного строения выделилось 21,09 г воды и выход продукта реакции составил 75% от теоретического. Определить строение спирта.
Урок-коррекция.
1 этап. 10-15 минут. Учащиеся задают вопросы по тренировочным упражнениям.
2 этап. 20-30 минут. Самостоятельная работа. Работа разноуровневая. Учащиеся выбирают любой вариант.
Самостоятельная работа (тема: “Одноатомные спирты”).
Оценка “удовлетворительно”
| Вариант 1 | Вариант 2 |
|
1. Какие вещества называют спиртами? (привести примеры). 2. Какие спирты образуются в результате гидратации следующих веществ: этена, бутена-2. 3. Осуществить превращения: 1)С2Н 5 ОН->С2Н 4 ->С2Н 5 Cl->С2Н5 ОН 2)ацетилен- >А-> этанол 4. При взаимодействии 12,8 г спирта с натрием образовалось 4,48 л водорода. Какой это спирт? |
1. Написать общую формулу спиртов. Что такое функциональная группа? 2. Написать уравнение гидролиза водным раствором щелочи следующих соединений: хлорэтана, 2-хлорбутана. 3. Осуществить превращения: 1)СН 4 -> С2Н 2 -> С2Н 4 -> С2Н 5 ОН 2)этанол -> А-> этан 4. При дегидратации 12 г спирта образовался алкен и 3,6 г воды. Какой это спирт? |
Оценка “хорошо”
| Вариант 3 | Вариант 4 |
|
1. Объяснить образование водородных связей между молекулами спирта и влияние на физические свойства. 2. Как получить спирты из алкенов (привести два примера). 3. Осуществить превращение: оксид углерода (IV) – метанол – хлорметан – этан – углекислый газ. 4. Найти молекулярную массу вещества А: пропанол-1 – А - пропанол-2 5. 0,5 моль метанола нагрели с KBr и H2SO4 и получили 38 г бромметана. Найти выход бромметана |
1. Как доказать, что спирты отравляюще и пагубно действуют на организм человека. 2. Дописать уравнения и назвать вещества. 1. СН 3 – CHCl - СН 2 - СН 3 + КОН(водн) 2. СН 3 – CHCl - СН 2 - СН 3 + КОН(спирт) 1. Осуществить превращения: метан – этан – этен – этанол – углекислый газ 2. Определить молекулярную массу вещества А: этанол – А – 1,2-дихлорэтан. 3. Какая масса этилата натрия получится при взаимодействии этанола массой 11,5 г с натрием массой 9,2 г? |
Оценка “отлично”
| Вариант 5 | Вариант 6 |
|
1. Почему температура кипения спиртов намного выше, чем соответствующих углеводородов? 2. Сколько изомерных бутиловых спиртов может образоваться из изомерных алкенов С4Н 8 при их гидратации? 3. Написать уравнения реакций, в результате которых можно получить из метана бутадиен-1,3. 4. Метанол массой 2,04 кг получили взаимодействием оксида углерода (11) объемом 2 м3 с водородом объемом 5 м3 (ну). Найти выход продукта реакции. 5. Определить массу пропанола-2, взятого для реакции, если во время дегидратации пропанола-2 получили пропен, который обесцветил бромную воду массой 200 г. Массовая доля брома в бромной воде равна 3,2%. |
1. Почему нельзя физическими методами получить 100%-ный этанол из его водного раствора? 2. Сколько изомерных третичных спиртов имеют состав .С6Н13 ОН ? Написать формулы и назвать . 3. Написать уравнения реакций, в результате которых можно получить из метана диэтиловый эфир. 4. Какую массу бутадиена-1,3 можно получить из спирта объемом 230 л и плотностью 0,8 кг/л, если массовая доля этанола в спирте 95%? Выход продукта реакции составляет 60%. 5. Вычислить массу добытого продукта, если выход на обеих стадиях синтеза составляет по 60%, если известно, что из пропанола-2 массой 24 г добыт 2-бромпропан, из которого синтезировали 2,3-диметилбутан. |
Химические свойства спиртов
Одноатомные спирты не обладают ни щелочными, ни кислотными свойствами. Водные растворы спиртов на индикаторы не действуют.
Рассмотрим химические свойства спиртов на примере этанола. В молекуле этилового спирта СН3–СН2–ОН имеется четыре типа химических связей, различающихся полярностью: 1) Н–О;
2) С–О; 3) С–Н; 4) С–С. В результате химических превращений разрываются наиболее полярные связи Н–О, С–О и С–Н. Неполярная связь С–С в реакциях спиртов не разрывается.
1. Разрыв связи Н–О в реакции с натрием:
![]()
2. Одновременный разрыв связей Н–О и С–Н, находящихся при спиртовом атоме углерода, под действием окислителя (CuO) с отщеплением молекулы Н2О и образованием альдегида (СН3СНО):
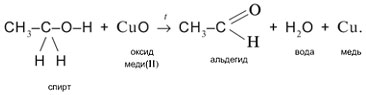
2.
Разрыв
связи ![]() под действием
нуклеофильных реагентов (ионов В– или молекул с неравномерным
распределением заряда в молекуле
под действием
нуклеофильных реагентов (ионов В– или молекул с неравномерным
распределением заряда в молекуле ![]() ) в кислой среде.
) в кислой среде.
3. а) Действие кислот НСl или НВr с образованием галогеналканов:
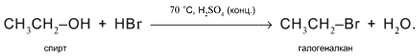
б) Действие кислородсодержащих кислот – неорганических и органических – с образованием сложных эфиров (подробнее см. урок 29):
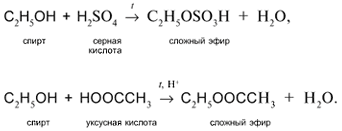
Модель нуклеофильного и электрофильного процессов
4. Внутримолекулярное отщепление Н и ОН от соседних атомов С в присутствии концентрированной серной кислоты при нагревании с образованием алкена:
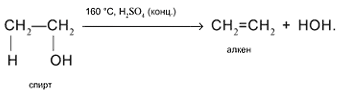
5. Межмолекулярное отщепление Н и ОН от двух разных молекул спирта при умеренном нагревании в присутствии дегидратирующих агентов. Продукт реакции – простой эфир:
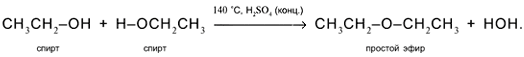
6. Спирты горят на воздухе с расщеплением всех связей и образованием углекислого газа и воды:
С2Н5ОН
+ 3О2 ![]() 2СО2 + 3Н2О.
2СО2 + 3Н2О.
Задача. Составьте уравнения реакций пропанола-1 СН3СН2СН2ОН со следующими реагентами: а) Na; б) CuO; в) HCl в присутствии H2SO4 (конц.) при нагревании; г) H2SO4 (конц.) при 160 °С (продукт – алкен); д) H2SO4 (конц.) при 140 °С (продукт – простой эфир).
Решение
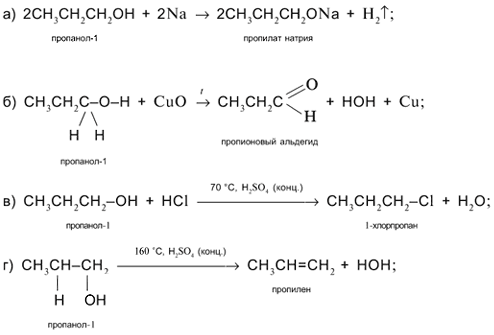
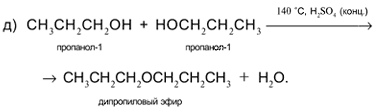
1. Составьте уравнения реакций пропанола-2 СН3СН(ОН)СН3 со следующими реагентами:
а) Na; б) CuO; в) HCl в присутствии H2SO4 (конц.) при нагревании; г) H2SO4 (конц.) при 160 °С (продукт – алкен); д) H2SO4 (конц.) при 140 °С (продукт – простой эфир).
2. Алюминий реагирует со спиртами подобно натрию. При этом происходит замещение гидроксильного водорода на металл и выделение свободного водорода Н2. Реакция протекает при нагревании около температуры кипения спирта. Составьте уравнения реакций металлического алюминия со спиртами: а) метанолом; б) этанолом.
3. Почему температуры кипения спиртов выше, чем у соответствующих по молекулярной массе углеводородов (С2Н5ОН, Мr = 46, tкип = 78 °С; С3Н8, Мr = 44, tкип = –42 °С)?
4. Напишите схему реакций, с помощью которых пропанол-1 можно превратить в пропанол-2.
Из спиртов ROH получают соединения многих других классов: алкилгалогениды RHal, алкены R'СН=СН2, простые эфиры RОR', сложные эфиры R'СООR, альдегиды R'СНО, карбоновые кислоты R'СООН и т.д. Спирты используют в качестве растворителей при синтезе новых соединений, производстве лаков и красок, фармацевтических препаратов, душистых веществ, парфюмерно-косметической продукции. Этанол используют как дезинфицирующее средство, горючее в двигателях. Он идет также на изготовление алкогольных напитков.
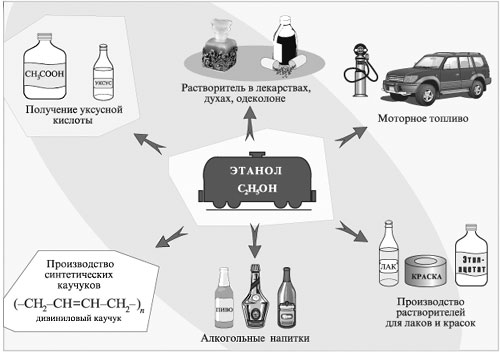
Применение этилового спирта
Для прочного усвоения знаний по химии надо овладеть умением составлять и решать цепочки химических превращений. Решить цепочку – это значит записать уравнения реакций, соответствующие каждой стрелке схемы. В результате удается из имеющихся в наличии веществ получать новые необходимые вещества. Для решения цепочек необходимо знать:
а) способы получения веществ и б) химические свойства веществ различных классов.
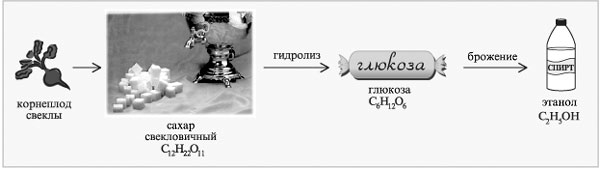
Пример цепочки химических превращений в производстве этанола
Задача. Составьте уравнения реакций для цепочки превращений:
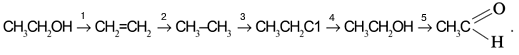
Решение
Воспользуемся удобным способом, помогающим определять реагенты, требуемые для превращения одного вещества в другое: будем находить отличие в составе двух веществ, стоящих по разные стороны от стрелки, и из химической формулы с большим числом атомов вычитать формулу с меньшим числом атомов. Так, для первой стрелки схемы:
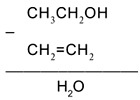
Следовательно, чтобы превратить спирт СН3СН2ОН в алкен СН2=СН2, надо отщепить молекулу воды от молекулы спирта:
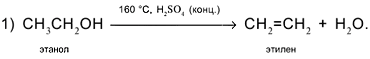
Вторая реакция схемы состоит в присоединении водорода к алкену:
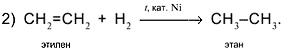
Третья стрелка схемы представляет реакцию замещения водорода в алкане СН3–СН3 на хлор. Это достигается действием молекулярного хлора на алкан:
![]()
Четвертое превращение – замещение атома хлора в хлорэтане С2Н5Сl на гидроксильную группу ОН:
![]()
Пятая реакция заключается в отщеплении двух атомов водорода от молекулы спирта. На практике это означает окисление спирта кислородом [O] окислителя, т.е. связывание избыточных атомов Н в форме Н2О:
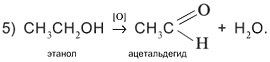
ЛИТЕРАТУРА
1. О.В. Байдалина. О прикладном аспекте химических знании // Химия в школе, 2005, № 5, с. 45-47.
2. Ахметов Н.С. Методика преподавания темы «Закономерности протекания химических реакций» // Химия в школе. 2002, № 3, с. 15 – 18.
3. Ахметов Н.С. Учебник для 8 класса общеобразовательных учреждений. М.: Просвещение, 1998 г.
4. Рудзитис Г.Е., Фельдман Р.Г. Учебник для 8 класса средней школы. М.: Просвещение, 1992.
5. Материалы сайта www.1september.ru
6. О.С. Габриелян, Н.П. Воскобойникова, А. В. Ящукова. Настольная книга учителя. Химия. 8 класс. М.: Дрофа, 2003 г.
7. Малинин К.М. Технология серной кислоты и серы. М., Л., 1994.
8. Васильев Б.Г., Отвагина М.И. Технология серной кислоты. М., 1985.
9. Отвагина М.И., Явор В.И., Сретенская Н.С., Шарифов М.Ю. Промышленность минеральных удобрений и серной кислоты. М., НИИТЭХИМ. 1972. Выпуск № 4.
10. Резницкий И.Г. Возможности использования нитрозного способа для переработки газов автогенных процессов на серную кислоту / Цветные металлы. 1991. № 4.
11. Березина Л.Т., Борисова С.И. Утилизация фосфогипсов - важнейшая экологическая проблема // Химическая промышленность. 1999 г. № 12.
12. Громов А.П. Экологические аспекты производства серной кислоты // Экология и промышленность России. 2001, № 12.
13. Лидин Р.А. Химия: Руководство к экзаменам / Р. А. Лидин, В. Б. Маргулис. – М.: ООО Издательство «АСТ»: ООО «Издательство Астрель», 2003. с. 64 – 70.
14. Единый государственный экзамен 2002: Контрольные измерительные материалы: Химия / А.А. Каверина, Д.Ю. Добротин, М.Г. Снастина и др.; М.: Просвещение, 2002. – с. 39 – 51.
15. Химия: Большой справочник для школьников и поступающих в вузы / Е.А. Алферова, Н.С. Ахметов, Н.В. Богомолова и др. М.: Дрофа, 1999. с. 430-438
16. Р.П. Суровцева, С.В. Сафронов. Задания для самостоятельной работы по химии. М.: Просвещение, 1993 г.